npj | цифровая медицина: интерпретируемый искусственный интеллект конструирует персонализированные характеристики структурных аберраций мозга у пациентов с БА
краткое содержание:На основании магнитно-резонансной томографии(MRI)данные Глубокое обучение имеет большой потенциал в диагностике и прогнозировании неврологических заболеваний.,Однако клиническое применение ограничено.,Из-за своей непрозрачности. В этом исследовании пациенты с деменцией отличались от здоровых людей путем обучения сверточной нейронной сети (CNN).,и предоставить объяснения на индивидуальном уровне, используя многоуровневое корреляционное распространение (LRP).,Преодолел это испытание. Проверка показывает,Идентификация модели согласуется со знаниями о структурных аберрациях мозга при деменции. При легких когнитивных нарушениях (MCI) концентрация данных,Интерпретируемый классификатор деменции предсказывает переход к деменции,Его пространственно богатая интерпретация дополняет предсказания Модели.,и охарактеризовать отдельные проявления заболеваний головного мозга. Мы построили морфологическую запись,Визуализация количества и локализации патологии деменции,Отслеживайте прогрессирование заболевания. Морфологические записи не только подтверждают достоверность корреляции.,Также раскрывается его клиническая полезность для стратификации пациентов и прогнозирования прогрессирования заболевания.,Обеспечивает мощную поддержку точной медицины.
1. Введение
С момента появления технологии магнитно-резонансной томографии (МРТ) в 1970-х годах она предоставила беспрецедентные возможности неинвазивного исследования внутренней структуры человеческого тела. В области нейробиологии изображения, полученные с помощью МРТ-сканеров, широко используются для интерпретации различий между мозгом пациентов с различными неврологическими заболеваниями и мозгом здоровых людей. Традиционно этот процесс включает сбор данных от группы пациентов с конкретным заболеванием и аналогичных здоровых людей, применение методов статистического вывода для выявления существенных различий в пространственном расположении мозга между группами. Эти местоположения представляют собой не простые точки пространственных координат, а морфологические области, определенные атласами, которые отражают эмпирическое или теоретическое понимание структуры мозга. Основным преимуществом использования морфометрических атрибутов, таких как толщина или объем предопределенных областей, для описания этих межгрупповых различий является естественная интерпретируемость результатов: области мозга.
Возможности современной технологии сканирования мозга с высокой степенью локализации еще больше улучшили способность точно описывать, где и как мозг человека отклоняется от ожидаемых (обычно здоровых) норм. Однако, хотя были обнаружены некоторые существенные эффекты, они, как правило, неуловимы и имеют относительно ограниченную прогностическую силу на индивидуальном уровне, что поднимает вопросы о том, могут ли существующие аналитические методы адекватно моделировать сложные психологические или клинические явления. Для решения этой проблемы предлагаются новые концептуальные подходы, которые подчеркивают создание более выразительных структур моделирования, которые отражают групповые различия путем захвата сложных нелинейных взаимодействий между множеством потенциально удаленных областей мозга и прогнозирования ориентированности на ядро. Такая гибкость моделирования естественным образом достигается за счет искусственных нейронных сетей (ИНС), класса статистических методов обучения, которые объединяют аспекты многоуровневых данных и могут точно решать сложные задачи прогнозирования.
Однако, хотя эти методы часто способны обеспечить высокую точность прогнозирования, например, продемонстрировать точность классификации, достаточную для того, чтобы отличать случаи от контроля в различных клинических сценариях, они делают это за счет непрозрачности в принятии решений модели, поскольку правила принятия решений принятые модели трудно интуитивно понять человеку. Эта характеристика «черного ящика» широко считается важным фактором, ограничивающим его широкое применение в критически важных областях безопасности, таких как медицина. Чтобы преодолеть это ограничение, появление технологии объяснимого искусственного интеллекта (XAI) открывает возможный путь для анализа поведения искусственных нейронных сетей. XAI предоставляет широкий спектр объяснений, охватывающих различные типы моделей, концептуальный уровень, на котором находится объяснение, и конкретную аудиторию, для которой оно предназначено. В области компьютерного зрения XAI занимается посмертным объяснением отдельных решений, то есть того, почему аналитическая модель сделала определенный прогноз для конкретного изображения. Обычно оно отображается в виде интуитивной тепловой карты с указанием. вклад различных областей изображения в прогноз.
Распространение многоуровневой корреляции (LRP), вариант этого класса методов, генерирует карты корреляции путем распространения корреляций обратно из пространства прогнозирования на каждый уровень модели и, в конечном итоге, в пространство изображений. Основным преимуществом LRP является его интуитивный механизм объяснения: благодаря способу его построения гарантируется, что общая сумма корреляций между представлениями различных слоев, способствующих прогнозированию, остается неизменной. Таким образом, корреляция, передаваемая обратно во входной воксель, напрямую отражает влияние этого воксела на результат прогнозирования. В последние годы LRP и другие объяснимые методы искусственного интеллекта были применены к исследованиям деменции, и было обнаружено, что эти тепловые карты часто выделяют области, которые соответствуют известным изменениям при деменции. Однако, хотя LRP продемонстрировал потенциал поддержки принятия клинических решений в точной медицине, возможность использования точно индивидуализированных тепловых карт, создаваемых LRP, для точного определения индивидуальных проявлений заболевания не была полностью изучена.
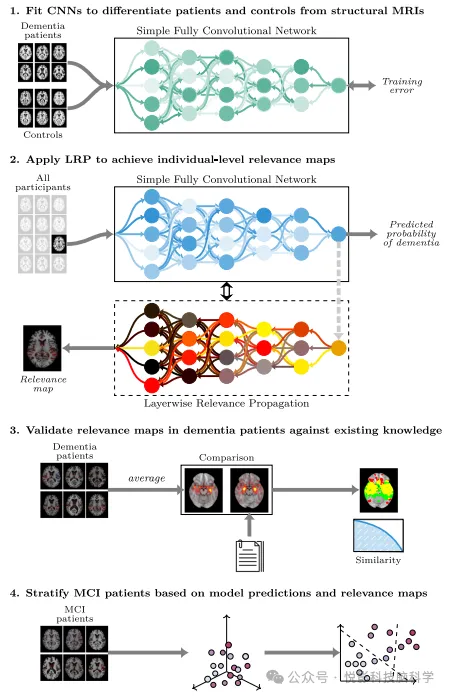
Рисунок 1. Обзор процесса моделирования.
В этом исследовании,Мы стремимся применить глубокое обучение и технологию XAI к МРТ-сканированию мозга.,Сделать интерпретируемые и клинически значимые прогнозы деменции на индивидуальном уровне.(Рисунок 1)。Мы используем передовую нейровизуализациюданные Архитектура,Обучение сверточной нейронной сети (CNN) для дифференциации пациентов с деменцией от здоровых людей на основе T1-взвешенной структурной МРТ. а потом,Реализуем LRP на обученной Модели,Построить процесс расчета,Для создания корреляций на индивидуальном уровне изображение в качестве объяснения предсказаний Модели. Подтвердив это на субпопуляциях пациентов с деменцией,Мы сравниваем не только с существующими знаниями об анатомическом распределении структурных искажений как в качественном, так и в количественном контексте.,Эти ассоциации были дополнительно изучены на предмет их потенциальной прогностической ценности в прогнозировании перехода к деменции у пациентов с легкими когнитивными нарушениями (MCI). также,Мы стремились изучить, как эти записи могут стратифицировать пациентов на основе их конкретных клинических характеристик и прогрессирования заболевания.,Чтобы отразить широкие перспективы клинического применения интерпретируемой ИИ в точной медицине.
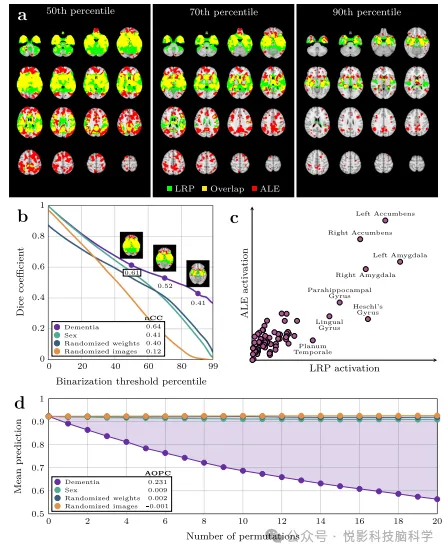
Рисунок 2. Сравнительная проверка с использованием трех альтернативных методов.
2. Результаты
Мы тщательно объединили данные МРТ из нескольких источников, чтобы создать набор данных о 854 гетерогенных пациентах с деменцией в возрасте от 47 до 95 лет, 47% из которых составляли женщины. Этот набор данных основан на нескольких диагностических категориях и строгих диагностических критериях включения, а также устанавливает контрольную группу, которая строго соответствует с точки зрения места проведения, возраста и пола. На этапе обучения модели мы использовали несколько архитектур сверточных нейронных сетей (CNN), направленных на точное различение вышеуказанных групп пациентов. Применяя стратегию перекрестной проверки, мы воспользовались всеми доступными данными о временных точках для каждого участника в трех тренировочных секциях и случайным образом выбрали момент времени для каждого участника, который будет оцениваться в отдельных проверочных и тестовых секциях. Когда мы объединили результаты прогнозов за пределами выборки от всех участников во всех группах, мы наблюдали чрезвычайно удовлетворительную дискриминационную способность прогнозов, сделанных моделью с лучшими показателями проверки. В частности, в результате этих прогнозов общая площадь под кривой рабочей характеристики приемника (ROC) (AUC) составила 0,908 в диапазоне от 0,904 до 0,920 по сгибам, демонстрируя чрезвычайно высокую точность. Точность составляет 84,95%, а диапазон делений складки составляет от. от 83,04% до 87,13%. Этот результат не только сопоставим с аналогичными исследованиями, которые классифицируют определенные подтипы в одном наборе данных, но даже немного лучше в некоторых аспектах, что еще раз подчеркивает большой потенциал и надежность нашего подхода.
2.1 Карта корреляции точно определяет аномальные участки мозга у пациентов с деменцией
Классификатор на основе оптимального значения AUC в наборе проверки.,Мы создаем конвейер прогнозирования деменции с улучшенной интерпретируемостью,Этот процесс интегрирует комплексную стратегию LRPdementia.,и расставить приоритеты в областях мозга, которые положительно влияют на прогнозирование деменции. используйте этот процесс,Мы нацелены на всех участников,Включает тех, кто не участвовал в модельном обучении.,Был рассчитан вневыборочный корреляционный спектр изображения. С качественной точки зрения,Эти спектры изображений не только подтверждают анатомическое расположение известных структурных искажений при деменции.,Также были выявлены тонкие различия между людьми. Эта ссылка картинаG тщательно построена на основе предыдущих исследований.,Обеспечивает прочную основу для этого сравнения. Мы выполняем обработку бинаризации с обеих сторон изображения при разных порогах.,и рассчитатьDiceПерекрывать(Рисунок 2a),Достигается точное сравнение с эталонным изображением. результат Показать,По мере увеличения порога бинаризации,Три альтернативных процесса и ссылкикартина Величина перекрытия монотонно уменьшается(Рисунок 2b),При деменции наблюдается более стабильное перекрытие.,Даже когда земля становится более редкой,Количество перекрытий остается высоким,Это полностью доказывает высокое сходство между Rdementia и G. дальше,Нормализованная взаимная корреляция между Rdementia и G достигает 0,64.,Значительно превышает 0,41, 0,40 и 0,12 других альтернативных процессов.,Этот количественный показатель еще раз подтверждает превосходство Рдеменции. также,Мы также провели региональное качественное сравнение между Rdementia и G.,Оба демонстрируют высокую степень последовательности в обозначении ключевых областей.(Рисунок 2c),Оба подчеркивают важность таких областей, как прилежащее ядро, миндалевидное тело и парагиппокампальная извилина. Проверить ключевую роль этих регионов в прогнозировании.,Мы реализовали итеративную процедуру маскировки и прогнозирования. для каждого участника,Мы сгенерировали базовые прогнозы деменции y и корреляции R в соответствии с конвейером. впоследствии,Упорядочиваем важность актуальности,Постепенно маскируйте ключевые области изображения.,И наблюдайте за изменением тенденции прогнозируемого значения.(Рисунок 2d)。Рассматриваем только настоящие положительные моментырезультатслучай,В идеале прогнозируемое значение должно начинаться близко к 1,0 (фактическое среднее значение составляет 0,89).,По мере увеличения площади маски она постепенно приближается к 0,5 (что представляет собой случайное предсказание). Наблюдаемая скорость снижения прогнозируемых значений напрямую отражает, содержит ли замаскированная область ключевую информацию, необходимую классификатору для правильной классификации изображения.,Это еще раз подтверждает объяснительную силу и надежность Rdementia в прогнозировании деменции.
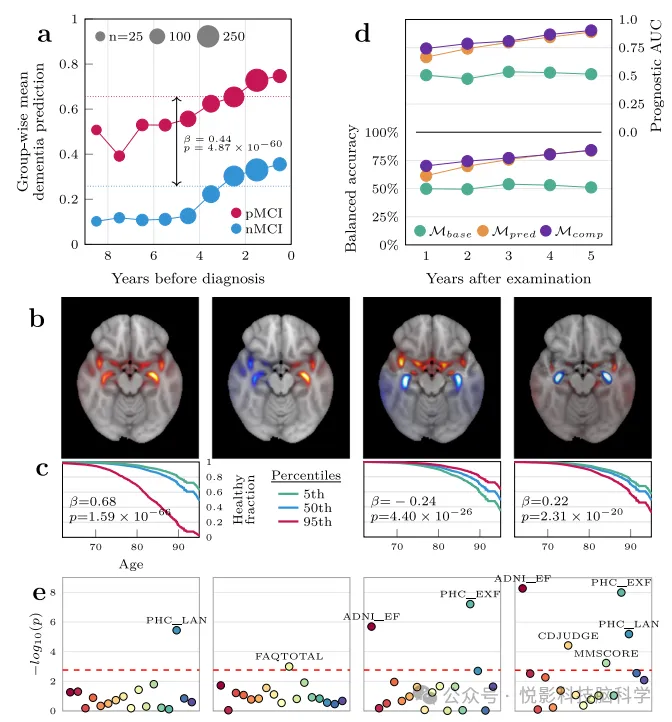
Рисунок 3. Полезность подхода, основанного на деменции, для прогнозирования прогрессирования и характеристики систематических ошибок на индивидуальном уровне в когорте с легкими когнитивными нарушениями.
2.2 Результаты процесса интерпретации имеют прогностическую ценность для пациентов с MCI.
Для всех 1256 ранее не подвергавшихся воздействию пациентов с легкими когнитивными нарушениями (MCI),Общее количество охваченных временных точек достигло 6448.,Мы тщательно построили среднюю модель интеграции. Модель предназначена для создания одной внешней выборки прогнозируемых результатов и спектра корреляционной картины для каждого пациента во все соответствующие моменты времени.,Вместе они образуют подробную морфологическую запись.(Рисунок 4)。Эта морфологическая запись интуитивно демонстрирует Модель Патологические изменения, связанные с деменцией, обнаруженные с течением времени,Не только количественно характеризует абсолютное количество патологий через прогностическую ценность.,Местоположение этих изменений было точно установлено с помощью корреляционного спектра картины. Начиная с точки зрения качественного анализа,Мы заметили, что эти прогностические значения и корреляционные спектры картины остаются относительно стабильными с течением времени у отдельных пациентов.,Он также показывает достаточную изменчивость,Таким образом, можно очертить их уникальные траектории патологических изменений. Для дальнейшего изучения потенциальной ценности предлагаемых нами морфологических записей в прогностической оценке.,Исходя из траектории изменения состояния пациента в течение периода наблюдения, мы,Больные МКИ были тщательно разделены на три подгруппы: в первую группу вошли пациенты, состояние которых имело тенденцию к улучшению (n=80), во вторую группу вошли пациенты с МКИ, состояние которых оставалось стабильным в течение всего периода наблюдения и у которых не было диагностировано деменции (деменция); n=80), n=754); третью группу составили пациенты с п МКИ, состояние которых ухудшилось и в конечном итоге перешло в деменцию (n=304). Стоит отметить, что,Еще у 118 пациентов в начальный момент времени был диагностирован статус без MCI.,Или покажите более сложную траекторию диагностических изменений (например, MCI→AD→CN и т. д.).,и были осторожно исключены из последующего углубленного анализа.
Были большие групповые различия в прогнозировании деменции, приводящие к потенциальному диагнозу, что позволяет предположить, что это биомаркер с врожденной прогностической ценностью, но наиболее поразительной частью наших морфологических данных является график корреляции. Поэтому мы провели исследовательский анализ на этой основе, чтобы дополнительно дифференцировать непрогрессивные и прогрессивные группы и охарактеризовать меж- и внутригрупповую гетерогенность. Однако, учитывая высокую размерность атласа и относительно небольшое количество пациентов, мы сначала MCI Карты корреляции пациентов с использованием анализа главных компонент (PCA), эффективно сжимает свое информационное содержимое в меньший набор переменных признаков с точки зрения кодирования графа, тем самым обеспечивая последующий анализ. анализировать. Мы сохранили тот, который объяснял наибольшую дисперсию. 64 ингредиенты,и заметил, что качественно они группируются в три всеобъемлющие категории. Первый компонент — это общий компонент, который определяет общую корреляцию.,Похож на обычного человека с деменцией.,Поэтому сформируйте кластер сам по себе. Следующий кластер состоит из следующих трех компонентов,Эти компоненты фиксируют абстрактные связанные шаблоны высокого уровня.,т.е. различия в латерализации вдоль сагиттальной оси и подкорковых областей(Рисунок 3б)。финальный Кластеризация состоит из остальных 60 компоненты, которые отражают конкретные сложные закономерности корреляций присутствия/отсутствия в регионах, выявленные в предыдущих анализах. Чтобы исследовать потенциал использования корреляционных карт для прогнозирования, мы сначала использовали Cox Модели пропорциональных рисков использовались для анализа выживаемости, в котором диагноз считался окончательным событием.
Конкретно,Мы смоделировали тенденции изменения доли населения, у которого не установлен диагноз, в зависимости от возраста.,и умело учитывать факторы нагрузки субъекта в качестве предикторов в анализе главных компонентов (PCA). После тщательной коррекции,мы определяем37ингредиенты与未确诊状态之间存在显著相关性(Рисунок 3c)。Однако,Для изучения прогностической ценности деменции был проведен стратифицированный анализ (y,и установил эквивалентную модель,Результат показывает, что даже в этой ситуации,29 ассоциаций остались значимыми,И все коэффициенты имеют одинаковый знак. но,Этот анализ еще не полностью включил в себя прогнозирующую и корреляционную спектральную информацию о динамике участников с течением времени. с этой целью,Далее мы смоделировали сценарий, близкий к клинической реальности.,Эксплуатируйте только одних и тех же участников,Реконструировал задачу. Конкретно,Для каждого пациента с MCI в любой момент времени t,Мы исследовали, может ли информация о деменции LRP, полученная в момент t, быть,В годовых интервалах γ,Точно предсказать, разовьется ли человек до деменции в течение следующих пяти лет. Ключевым моментом является,Модель прогнозирования деменции не была представлена этим участникам на всех этапах процесса.,Это обеспечивает достоверность прогнозирования связи с деменцией LRP за пределами выборки. Мы используем стратегию вложенной перекрестной проверки.,Это гарантирует, что прогнозы прогресса также имеют возможности обобщения за пределами выборки. первый,Мы построили прогноз на основе возраста и пола. Модель,Результат показывает, что Модель не продемонстрировала прогнозирующую эффективность ни в какой момент времени.,Это подтверждает несмещенность набора данных с точки зрения возрастных и гендерных переменных. впоследствии,Мы включили прогностическую ценность модели предиктора деменции в качестве нового предиктора.,Это захватывающе,Это значительно улучшило качество прогнозирования на всех годовых интервалах.,Сложенное среднее значение через пять летAUCЕще больше Гандама0.889(Рисунок 3d)。наконец,В составной модели, содержащей векторы компонентов в качестве дополнительных предикторов.,Мы стали свидетелями дальнейшего улучшения качества прогнозов во все годы.,Пик AUC через пять лет достиг 0,903. В итоге,Наша лучшая модель, Модель, демонстрирует впечатляющие результаты в прогнозировании прогрессирования деменции у пациентов с MCI пять лет спустя.,Его AUC достигает 0,903.,Точность 84,1%,Положительная прогностическая ценность составляет 0,92.,Чувствительность 0,82.,Специфичность 0,86.,Это полностью демонстрирует большой потенциал этой модели в принятии клинических решений.
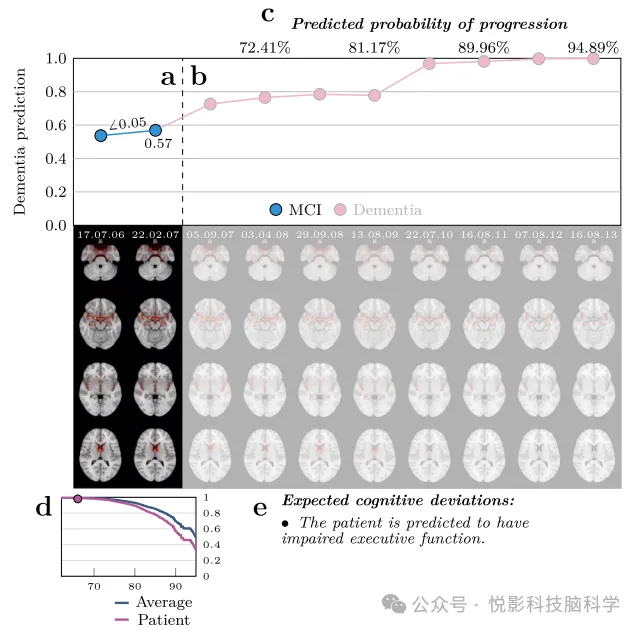
Рисунок 4. Визуализация морфологических записей случайно выбранных пациентов с МРП.
2.3 Аспекты корреляционной карты связаны с различными областями когнитивных нарушений.
финальный,Далее мы исследовали, связаны ли общие черты, выявленные с помощью анализа главных компонентов (PCA), со статусом нарушений в различных когнитивных и функциональных областях. с этой целью,Мы извлекли в общей сложности 17 суммарных показателей из 7 нейропсихологических тестов.,Эти тесты проводятся примерно в то же время, что и МРТ. впоследствии,Мы используем линейную модель,После учета возраста, пола и предикторов деменции в качестве ковариат.,Был проведен корреляционный анализ нагрузки КТ у 733 пациентов с легкими когнитивными нарушениями (MCI). После поправки ФДР,мы узнали18уникальныйPCAИнгредиенты и14Существует разница между когнитивными показателями48значительная корреляция(Рисунок 3e)。специально,Компонент 30 и общий балл по опроснику функциональной деятельности (FAQTOTAL) продемонстрировали самые высокие значимые корреляции в своих соответствующих категориях.,Оба достигли 6-го порога. Что особенно важно, так это,Эти компоненты PCA демонстрируют разнообразные модели ассоциации с различными когнитивными показателями.,выявили их специфику в отражении нарушений когнитивной функции. Чтобы исключить возможность того, что эти значимые ассоциации могут быть вызваны коллинеарностью между компонентами и y.,Мы провели параллельный анализ,Однако ^y не была включена в этот анализ в качестве предикторной переменной. результат Показать,Только 5/48 ранее значимых корреляций остались значимыми после удаления y.,Но знак коэффициента противоположный,Это еще раз демонстрирует независимость и надежность большинства ассоциаций. В итоге,Пространственные особенности, которые мы фиксируем в корреляционном спектре изображения и последующих векторах компонентов.,Сильно связана с несколькими моделями результатов нейропсихологического тестирования.,Эти тесты глубоко отражают фенотипическую гетерогенность пациентов с деменцией. Это открытие не только расширяет наше понимание патофизиологических процессов деменции.,Это также обеспечивает важную основу для будущих стратегий персонализированной оценки и вмешательства на основе визуализации.
3. Обсуждение
Учитывая тяжелое бремя деменции и ожидаемый рост ее распространенности, разработка инновационных технологических решений для диагностической и прогностической оценки является актуальной. Хотя деменцию часто рассматривают как однородное заболевание или разделяют на подтипы в зависимости от этиологии и патофизиологии, нарушения, траектории прогрессирования заболевания и когнитивные нарушения, наблюдаемые у пациентов, уникальны и сложны. Чтобы глубже понять гетерогенность, лежащую в основе мозга при деменции, мы использовали МРТ головного мозга и технологию объяснимого искусственного интеллекта (XAI) для обучения модели нейронной сети, позволяющей отличать пациентов с деменцией от здоровых людей, а также с помощью многоуровневого корреляционного распространения (LRP). Метод строит корреляционный граф с целью выявить логику принятия решений классификатором на индивидуальном уровне. Эти корреляционные карты не только успешно предсказали начало деменции с помощью индивидуального таргетинга и возможностей межрегионального анализа, но также подтвердили существующие знания об анатомическом распределении структурных искажений мозга. В исследовании пациентов с легкими когнитивными нарушениями (MCI) этот метод эффективно характеризовал межиндивидуальные различия в проявлениях заболевания и отслеживал траектории заболевания, связанные с когнитивными функциями, в нескольких областях. Хотя текущие результаты требуют более тщательной проверки в реальных клинических условиях, наша разработка XAI изначально продемонстрировала свой большой потенциал в оказании помощи врачам в мониторинге и оценке прогрессирования заболевания у отдельных пациентов.
Среди многих технологий XAI мы выбрали LRP в качестве основного инструмента интерпретации, главным образом, на основе его простого и понятного механизма интерпретации, а также высокой надежности и специфичности, продемонстрированных в предыдущих исследованиях. Эти характеристики имеют решающее значение для принятия клинических решений. Однако мы должны понимать, что простое получение осмысленных интерпретаций — это первый шаг на пути к клиническому применению ИИ в области нейровизуализации, и это далеко не конец. На рынке существует множество прогнозных моделей. Хотя они могут дать объяснения, им часто не хватает глубокого понимания, что вызывает опасения, что XAI может стать «формальной, но неясной» системой. Поэтому мы стремимся использовать эмпирические исследования, чтобы глубоко проанализировать природу этих объяснений, оценить их практическую ценность и создать необходимый фундамент доверия. В ходе нашего процесса проверки пояснительные карты, созданные конвейером деменции, не только продемонстрировали большую прогностическую силу, но и сохранили высокую степень согласованности с существующими медицинскими знаниями. По сравнению с тремя альтернативными конвейерами наш подход показал превосходные результаты на уровне патологии. Эти результаты проверки особенно важны, учитывая ограничения, выявленные ранее аналогичными подходами. Они не только подтверждают результаты предыдущих исследований, но также расширяют их и повышают уверенность в интерпретации модели. Наконец, мы подчеркиваем, что окончательная проверка технологии должна происходить во время ее фактического применения в клинических сценариях, то есть клинический персонал применяет технологию непосредственно к данным реальных пациентов. Этот шаг имеет решающее значение для обеспечения эффективности, безопасности и практичности технологии, а также является целью нашей будущей работы.
Мы не только демонстрируем эффективность корреляционных карт, но и предлагаем рассматривать их как передовое когнитивное и клиническое средство, направленное на всестороннее картирование многочисленных аспектов деменции. Чтобы углубить это исследование, мы проанализировали потенциал этих карт для прогнозирования перехода от легких когнитивных нарушений (MCI) к деменции и связали их с различными показателями когнитивной оценки, тем самым расширив объем текущего исследования. В обоих этих детальных анализах доказательства, хотя и предварительные, достаточны, чтобы показать, что эти карты содержат информацию, выходящую за рамки простых предсказаний модели, что указывает на их потенциальную ценность для принятия клинических решений.
Визуально продемонстрировать, как эти результаты могут помочь процессу принятия клинических решений.,мы проанализируемрезультат Интегрирован в предлагаемый набор морфологических записей.(Рисунок 4),Разработан для помощи врачам в точном обнаружении морфологических аномалий.,Это оптимизирует процесс диагностики. Путем глубокого фенотипирования,Мы стремимся уловить тонкие изменения в патофизиологии деменции.,Это не только поможет составить карту спектра гетерогенности заболеваний.,Это также указывает на точные биологические цели для будущих исследований. Для отдельных пациентов,Эта разработка представляет собой важный шаг на пути к персонализированной диагностике.,Может помочь в разработке более точных стратегий ведения заболеваний и планов паллиативного лечения.,И заложить прочную основу для реализации точной медицины в будущем.
Стоит отметить, что на нашей корреляционной карте такие области, как прилежащее ядро, миндалевидное тело и парагиппокампальная извилина, показали самую высокую плотность корреляции, и было подтверждено, что эти области являются ключевыми поврежденными областями в патологическом процессе деменции. Однако интересно, что гиппокамп не занимал заметного места в нашем анализе, несмотря на то, что он часто упоминался в аналогичных исследованиях. Это явление может быть связано с различиями в фактическом распределении патологии, но мы предпочитаем приписать его роли внутренних механизмов модели: сверточные нейронные сети (CNN) полагаются на пространственный контекст для идентификации областей мозга и оценки их состояния. охватываемый фильтром, часто превышает саму целевую область, в результате чего корреляционное позиционирование при обратном распространении LRP может не иметь точности на уровне вокселей. Кроме того, нашу модель можно рассматривать как широкий инструмент обнаружения атрофии, который предпочитает идентифицировать окружающие интерстициальные области, а не напрямую сосредотачиваться на самой конкретной области.
Хотя графики корреляции предоставляют ценную информацию, их интерпретация по-прежнему требует профессионального суждения врачей, чтобы максимизировать их ценность в клинической практике. Между тем, еще одним важным выводом нашего исследования является превосходная эффективность классификаторов деменции в прогнозировании. По сравнению с предыдущими исследованиями наша модель не только эффективно отличала пациентов с деменцией от здоровых людей из контрольной группы, но также успешно идентифицировала различия между пациентами с прогрессирующим и непрогрессирующим MCI за много лет до того, как была диагностирована деменция. Этот результат согласуется с результатами исследований, основанных на теории. из недавних исследований глубокого обучения, которые в совокупности показывают возможность обнаружения структурных изменений в мозге до появления клинических симптомов. Это открытие обеспечивает поддержку визуальной интерпретации для оценки риска на основе МРТ и предвещает широкие перспективы применения передовых технологий в раннем выявлении и диагностике. Раннее выявление пациентов с высоким риском будет иметь решающее значение, если будущие методы лечения будут проверены и широко доступны. Своевременное вмешательство может не только значительно улучшить качество жизни пациентов и лиц, осуществляющих уход за ними, но также эффективно замедлить процесс снижения когнитивных функций. Таким образом, продвижение высокоточных и простых в использовании технологий раннего обнаружения имеет неизмеримую ценность для решения проблемы предстоящего роста числа пациентов с деменцией и открытия окна более эффективного лечения.
Хотя наше исследование раскрывает большой потенциал интерпретируемого искусственного интеллекта и, в частности, многоуровневого корреляционного распространения (LRP), как трансляционной технологии обнаружения и характеристики деменции, следует признать его ограничения. Первое техническое соображение заключается в том, что существует абсолютная взаимозависимость между предсказаниями модели и построенными графиками корреляции, а это означает, что, когда модель неверна, ее интерпретируемость не всегда интуитивно понятна, особенно в случае ложноотрицательных результатов. Цифры неотличимы от истинных. негативы. Более того, хотя эти карты содержат достаточно информации для разъяснения прогнозов, они могут быть неполными и не отражать все данные МРТ, которые имеют решающее значение для диагностики, что особенно важно для персонализированной медицины. Мы смягчили эту проблему с помощью практических стратегий, таких как интеграция и целевое улучшение, но теоретическое уточнение основных методов все еще требует дальнейшего изучения, чтобы гарантировать целостность карты.
Помимо ограничений самой LRP, это исследование столкнулось и с другими проблемами. Неоднородность набора данных, который в основном состоит из таких баз данных, как ADNI и OASIS, ограничивает способность модели к обобщению при выводе о других причинах деменции. С этой целью мы выступаем за использование данных, полученных от групп пациентов с ранними когнитивными нарушениями, таких как клиники памяти, для повышения клинической полезности модели. В то же время, определение того, является ли широко используемый клинический ярлык деменции лучшей прогностической целью, также требует тщательного рассмотрения. Учитывая, что такие базы данных, как ADNI и AIBL, содержат богатую информацию о биомаркерах, мы поощряем будущие исследования для изучения взаимодополняемости между этими целями биологического прогнозирования и нашими выводами.
Обобщение вне выборки, особенно по сканерам и протоколам сбора данных, является еще одним ключом, который необходимо проверить. Хотя мы использовали данные с нескольких сайтов, чтобы частично решить эту проблему, еще предстоит реализовать более строгую проверку в сочетании с трансферным обучением (например, исключение определенных сайтов для независимой проверки). Мы подчеркиваем, что клиническая реализация должна быть основана на реальных данных, и рекомендуем, по крайней мере, точно настроить данные из соответствующих сайтов, сканеров и клинических протоколов, обеспечивая при этом соответствие частот классов в обученной модели клинической реальности. Кроме того, нам также необходимо обратить внимание на циклическую проблему проверки маски и прогноза, то есть области, которые модель считает важными, часто также являются ключевыми областями, которые определяют прогнозы, что может привести к ненезависимой проверке корреляционных карт. между разными моделями. Мы приняли стратегию поочередного тестирования и проверки, чтобы смягчить эту проблему, но полный отказ от циклических зависимостей по-прежнему потребует поддержки более крупных и независимых наборов данных. Хотя включение улучшающихся пациентов с МРП в модель прогрессирования может отражать реальные клинические сценарии, это также может упростить задачу прогнозирования из-за нестабильности состояния, тем самым преувеличивая показатели эффективности. Поэтому прогностическую ценность для отдельных пациентов следует интерпретировать с осторожностью. Однако наш обширный подход к проверке, углубленный анализ ограничений метода и полное использование больших наборов данных обеспечивают прочную основу для применения объяснимого ИИ в поддержке клинических решений при неврологических заболеваниях.
Таким образом, несмотря на множество проблем, наше исследование по-прежнему предоставляет ценный опыт и дорожную карту для применения интерпретируемого искусственного интеллекта на основе МРТ головного мозга в персонализированных системах поддержки клинических решений. Мы демонстрируем, что глубокая нейронная сеть, обученная на гетерогенном наборе МРТ-сканирований мозга, не только способна предсказывать деменцию, но и что ее прогнозы также могут эффективно интерпретироваться людьми. Что еще более важно, наша разработка может предоставить реалистичный и осуществимый клинический инструмент для точного фенотипирования и оценки прогноза посредством персонализированного определения структурных аберраций мозга у людей, демонстрирующих ранние признаки когнитивных нарушений.
4. Метод
4.1 Данные
Все данные, использованные в этой статье, были получены на основе ранее опубликованных и общедоступных результатов исследований. Эти исследования строго следовали принципу информированного согласия участников и получили официальное одобрение соответствующего институционального наблюдательного совета или комитета по этике. Это исследование проводилось под строгим контролем Норвежского регионального комитета по этике медицинских и медицинских исследований (REK) с соблюдением руководящих принципов Хельсинкской декларации на протяжении всего процесса для обеспечения этического соответствия исследования.
Чтобы построить прогностическую модель деменции, мы тщательно собрали набор данных «случай-контроль», охватывающий семь различных источников данных (подробности см. в дополнительной таблице 1), охватывающих пациентов с деменцией и состоянием здоровья из одного и того же сайта сравнения. Учитывая различия в диагностических критериях, принятых в исходном наборе данных, мы внедрили исчерпывающий набор правил для достижения единого и неоднородного определения ярлыка деменции (конкретные правила см. в дополнительной таблице 2). Мы отобрали участников с диагнозом деменция во все моменты времени, чтобы сформировать группу пациентов (n=854). Затем для каждого уникального прокси-сайта (особенно в ADNI, где мы используем напряженность поля в качестве прокси-сервера для сайта, учитывая разнообразие сканеров и протоколов сбора данных), мы используем такие критерии, как пол, десятилетний возрастной диапазон и т. д. Каждый пациент был сопоставлен с равным количеством здоровых контрольных групп, тем самым создав сбалансированный контрольный набор (всего n = 1708, подробности см. в Таблице 1). Перед моделированием мы дополнительно разделили набор данных на пять равных подмножеств (складок) и обеспечили, чтобы все данные каждого участника принадлежали к одной и той же свертке, чтобы достичь цели анализа данных на основе диагноза, места, пола и возраста. наслоение.
Для набора данных о легких когнитивных нарушениях (MCI) наш скрининг начался со всех участников с диагнозом MCI в базе данных ADNI, которые соответствовали ряду строгих диагностических критериев, включая субъективные жалобы на память, средний балл по MMSE от 24 до 30, балл CDR выше 0,5, оценка структуры памяти более 0,5, оценка по пересмотренной шкале памяти Вешлера ниже определенных пороговых значений (которые варьируются в зависимости от уровня образования) и, по крайней мере, в один момент времени вышеуказанные условия. Наконец, мы отфильтровали соответствующие данные из 6448 записей о посещениях 1256 участников, ни один из которых не использовался для обучения модели, чтобы обеспечить независимость набора данных. Этот строгий процесс скрининга не только гарантировал, что всем участникам был поставлен диагноз MCI хотя бы в один момент времени, но также позволил нам зафиксировать переход от нормального когнитивного статуса к MCI и прогрессирование от MCI к болезни Альцгеймера (pMCI). Перед последующим анализом мы исключили участников, у которых первый диагноз не был MCI и чья траектория диагноза была неясна, и, наконец, сохранили записи о 5607 посещениях 1138 участников.
Для двух вышеупомянутых наборов данных мы извлекли T1-взвешенные структурные данные МРТ каждого участника в каждый момент времени в качестве основных входных данных для последующей модели прогнозирования. Перед моделированием мы использовали зрелый процесс предварительной обработки для выполнения необходимой обработки исходного изображения, включая зачистку черепа и линейную регистрацию с шестью степенями свободы в стандартном пространстве MNI152. Этот процесс гарантирует, что обработанное изображение состоит из стандартизированных значений вокселей, что не только точно фиксируется в шаблоне общественного пространства, но и в наибольшей степени устраняет влияние немозговых тканей, закладывая прочную основу для последующего анализа.
4.2 Модель
Все построенные модели прогнозирования деменции основаны на простой полностью сверточной сетевой архитектуре, получившей награду на конкурсе PAC2019. Эти модели тщательно настроены для введения одного выходного нейрона с функцией активации сигмовидной кишки. Эта архитектура поддерживает простой и эффективный стиль VGG, состоящий из шести блоков свертки с общим размером параметров около 3 миллионов. Чтобы улучшить производительность инициализации модели, мы взяли веса из общедоступной модели прогнозирования возраста мозга, которая ранее продемонстрировала исключительные возможности обобщения для различных мест сканирования и протоколов.
На этапе обучения мы использовали платформу Keras для запуска всех моделей в среде Tensorflow 2.6.0 с использованием одного графического процессора Nvidia A100 с 40 ГБ памяти. Алгоритм обучения использует классический оптимизатор стохастического градиентного спуска (SGD), при этом скорость обучения определяется тщательной настройкой гиперпараметров (подробности см. в последующих главах) и фокусируется на минимизации потерь двоичной перекрестной энтропии. Весь процесс обучения длился 160 циклов, в каждой партии обрабатывалось по 6 образцов, а в качестве окончательной модели автоматически выбирался момент времени с наименьшими потерями в процессе проверки. В зависимости от конфигурации гиперпараметра время обучения одной модели незначительно варьируется и составляет в среднем около 4 часов.
Чтобы реализовать строгую и эффективную стратегию проверки, мы применяем модель трехкратного обучения и однократную проверку для каждой сохраненной тестовой складки, аналогично методу перекрестной проверки, который вводит дополнительный набор тестов вне выборки. Этот процесс обеспечивает объективные прогнозы для всех 1708 участников, поддерживая при этом гибкую настройку гиперпараметров. Мы тщательно оптимизировали ряд гиперпараметров, включая процент отсева (в диапазоне от 0,25 до 0,5) и коэффициент спада веса (от 10-3), а также исследовали различные стратегии планирования скорости обучения (такие как постепенное снижение, стратегии с одним циклом и несколькими циклами). ) и различные методы улучшения данных. Начальное значение скорости обучения тщательно устанавливается на основе подробных результатов сканирования скорости обучения, чтобы гарантировать, что предварительные знания предварительно обученной модели могут быть полностью использованы, и способствовать быстрой адаптации к новым задачам.
Поиск гиперпараметров был выполнен путем выполнения краткого поиска по сетке для 24 различных конфигураций, и модель с самым высоким показателем AUC в наборе проверки была выбрана для генерации прогнозов вне выборки, которые сохранили кратность теста. На заключительном этапе оценки модели мы агрегировали прогнозы всех участников, каждый из своей собственной модели тестового набора. В основном мы оцениваем эффективность модели через значения AUC. Принимая во внимание баланс соответствия выборки, мы также сообщаем соответствующие показатели точности.
4.3 MCI Исследовательский анализ когорт
В углубленном исследовании легких когнитивных нарушений (MCI) мы использовали модель деменции LRP для получения прогнозов для участников Инициативы по нейровизуализации болезни Альцгеймера (ADNI), у которых при зачислении был диагностирован MCI. График результатов и их корреляции. Во-первых, мы систематически интегрировали информацию о карте прогнозирования и корреляции (с временными метками) для каждого участника во все моменты времени оценки, чтобы построить архитектуру данных специально для морфологического анализа. Впоследствии, основываясь на этой структуре данных, мы стремились выделить три ключевые группы: стабильный MCI (sMCI), прогрессирующий MCI (pMCI) и тех пациентов, у которых наблюдалось улучшение когнитивных функций в период сбора данных. В то же время для удобства и направленности анализа мы объединили стабильные и улучшенные группы пациентов в группу без прогрессирования (nMCI), чтобы облегчить последующий бинарный сравнительный анализ.
Чтобы выяснить, связаны ли эти карты корреляции с конкретными изменениями когнитивных функций, мы дополнительно провели подробный сравнительный анализ различных аспектов карт с результатами различных нейропсихологических тестов. Этот процесс начался со сбора комплексных данных нейропсихологического тестирования из нескольких этапов проекта ADNI, включения итоговых оценок высокого уровня с веб-сайта ADNI, а затем ручной фильтрации данных по различным, но пересекающимся когнитивным областям, 17 ключевым сводным оценкам для областей. Мы используем эти итоговые оценки в качестве показателей когнитивных функций, используя при этом компоненты векторов c в качестве прокси для карт корреляции, причем каждый вектор представляет собой конкретный шаблон локализации патологии. Точно сопоставив 2402 вектора компонентов с результатами тестов 733 пациентов с MCI, мы создали прочную основу для последующего сравнительного анализа.
В ходе анализа мы провели одномерный статистический анализ связи между суммарным баллом каждого когнитивного домена и каждым компонентным вектором, строго контролируя возраст и пол как потенциальные искажающие факторы. Чтобы более точно оценить влияние патологической локализации, мы также скорректировали прогнозируемое значение деменции^y. Столкнувшись с несколькими потенциальными совпадениями, мы случайным образом выбрали момент времени, чтобы обеспечить объективный анализ, и окончательное количество точек данных, включенных в анализ, варьировалось от 518 до 675. Кроме того, мы использовали процедуру Бенджамини-Хохберга для корректировки множественных испытаний и повышения надежности результатов.
Чтобы гарантировать, что наблюдаемая связь не является результатом коллинеарности между c и y, мы также провели неисправленный эквивалентный анализ, чтобы убедиться, что знаки коэффициентов корреляции остаются постоянными. Эта серия строгих шагов направлена на то, чтобы предоставить нам более глубокое понимание взаимосвязи между изменениями когнитивных функций и локализацией патологии головного мозга у пациентов с MCI.
Задача: Построение персонализированных характеристик структурных аберраций головного мозга у пациентов с деменцией с использованием объяснимого искусственного интеллекта.

Неразрушающее увеличение изображений одним щелчком мыши, чтобы сделать их более четкими артефактами искусственного интеллекта, включая руководства по установке и использованию.
Копикодер: этот инструмент отлично работает с Cursor, Bolt и V0! Предоставьте более качественные подсказки для разработки интерфейса (создание навигационного веб-сайта с использованием искусственного интеллекта).
Новый бесплатный RooCline превосходит Cline v3.1? ! Быстрее, умнее и лучше вилка Cline! (Независимое программирование AI, порог 0)

Разработав более 10 проектов с помощью Cursor, я собрал 10 примеров и 60 подсказок.
Я потратил 72 часа на изучение курсорных агентов, и вот неоспоримые факты, которыми я должен поделиться!
Идеальная интеграция Cursor и DeepSeek API
DeepSeek V3 снижает затраты на обучение больших моделей
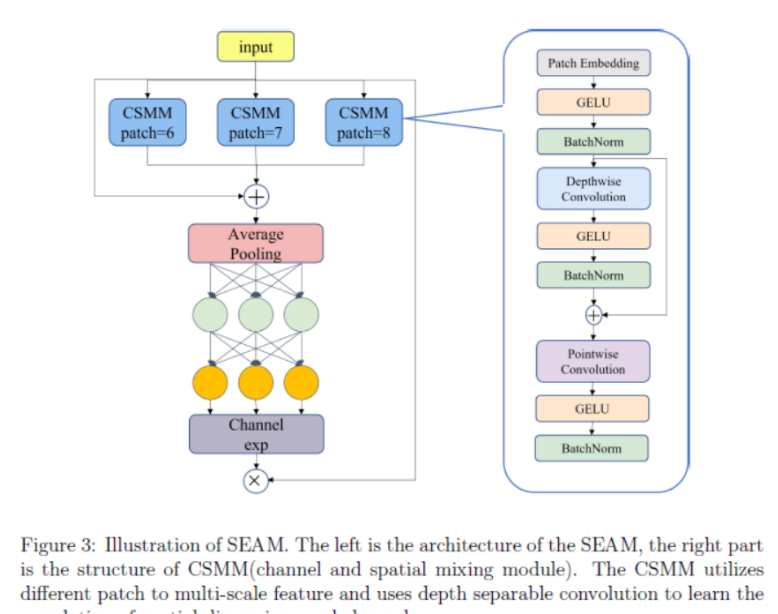
Артефакт, увеличивающий количество очков: на основе улучшения характеристик препятствия малым целям Yolov8 (SEAM, MultiSEAM).

DeepSeek V3 раскручивался уже три дня. Сегодня я попробовал самопровозглашенную модель «ChatGPT».

Open Devin — инженер-программист искусственного интеллекта с открытым исходным кодом, который меньше программирует и больше создает.
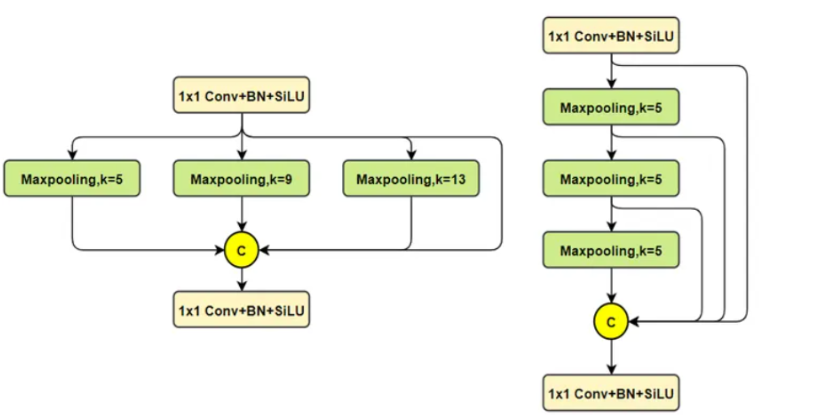
Эксклюзивное оригинальное улучшение YOLOv8: собственная разработка SPPF | SPPF сочетается с воспринимаемой большой сверткой ядра UniRepLK, а свертка с большим ядром + без расширения улучшает восприимчивое поле

Популярное и подробное объяснение DeepSeek-V3: от его появления до преимуществ и сравнения с GPT-4o.

9 основных словесных инструкций по доработке академических работ с помощью ChatGPT, эффективных и практичных, которые стоит собрать
Вызовите deepseek в vscode для реализации программирования с помощью искусственного интеллекта.
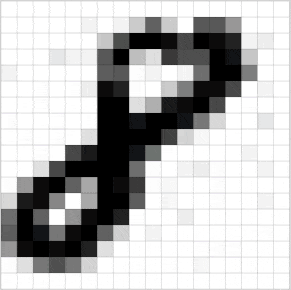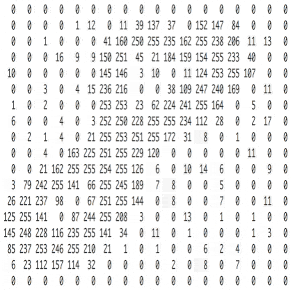
Познакомьтесь с принципами сверточных нейронных сетей (CNN) в одной статье (суперподробно)
50,3 тыс. звезд! Immich: автономное решение для резервного копирования фотографий и видео, которое экономит деньги и избавляет от беспокойства.
Cloud Native|Практика: установка Dashbaord для K8s, графика неплохая
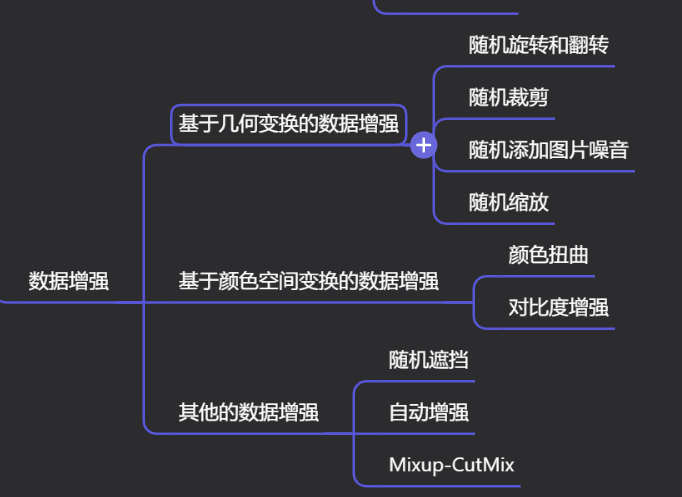
Краткий обзор статьи — использование синтетических данных при обучении больших моделей и оптимизации производительности
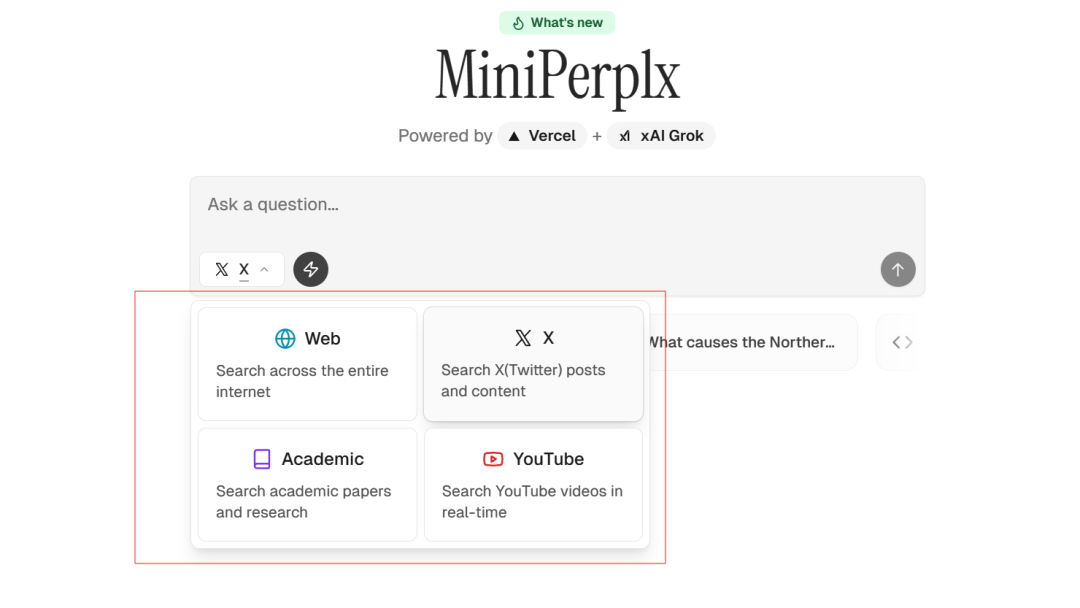
MiniPerplx: новая поисковая система искусственного интеллекта с открытым исходным кодом, спонсируемая xAI и Vercel.
Конструкция сервиса Synology Drive сочетает проникновение в интрасеть и синхронизацию папок заметок Obsidian в облаке.
Центр конфигурации————Накос
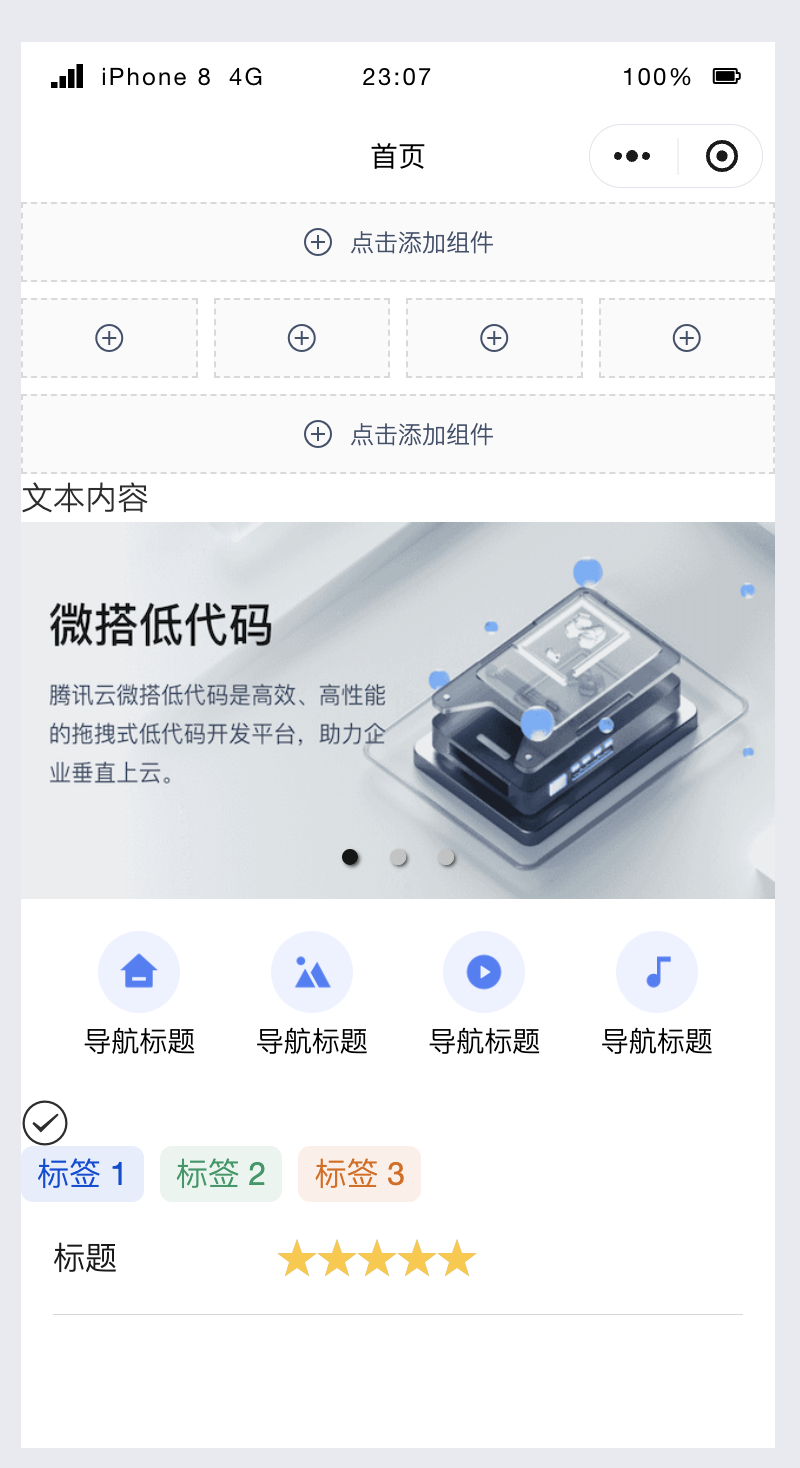
Начинаем с нуля при разработке в облаке Copilot: начать разработку с минимальным использованием кода стало проще

[Серия Docker] Docker создает мультиплатформенные образы: практика архитектуры Arm64

Обновление новых возможностей coze | Я использовал coze для создания апплета помощника по исправлению домашних заданий по математике

Советы по развертыванию Nginx: практическое создание статических веб-сайтов на облачных серверах
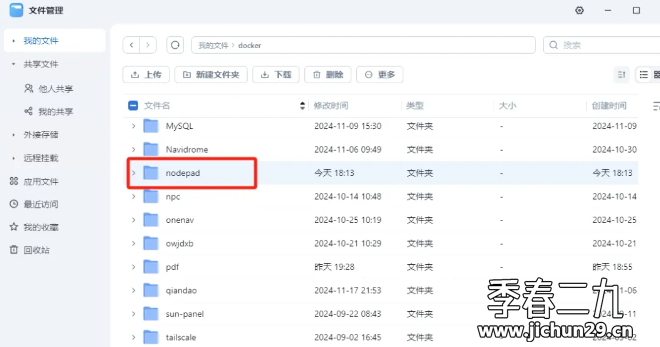
Feiniu fnos использует Docker для развертывания личного блокнота Notepad

Сверточная нейронная сеть VGG реализует классификацию изображений Cifar10 — практический опыт Pytorch
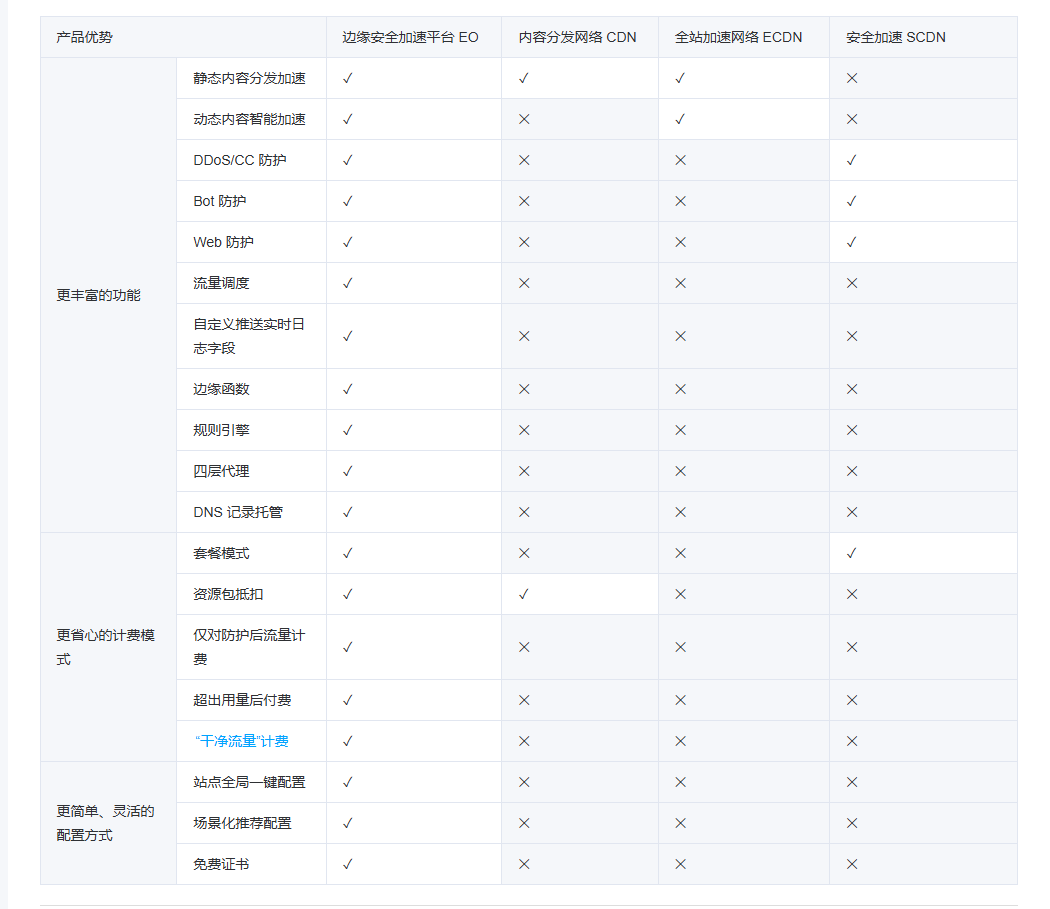
Начало работы с EdgeonePages — новым недорогим решением для хостинга веб-сайтов
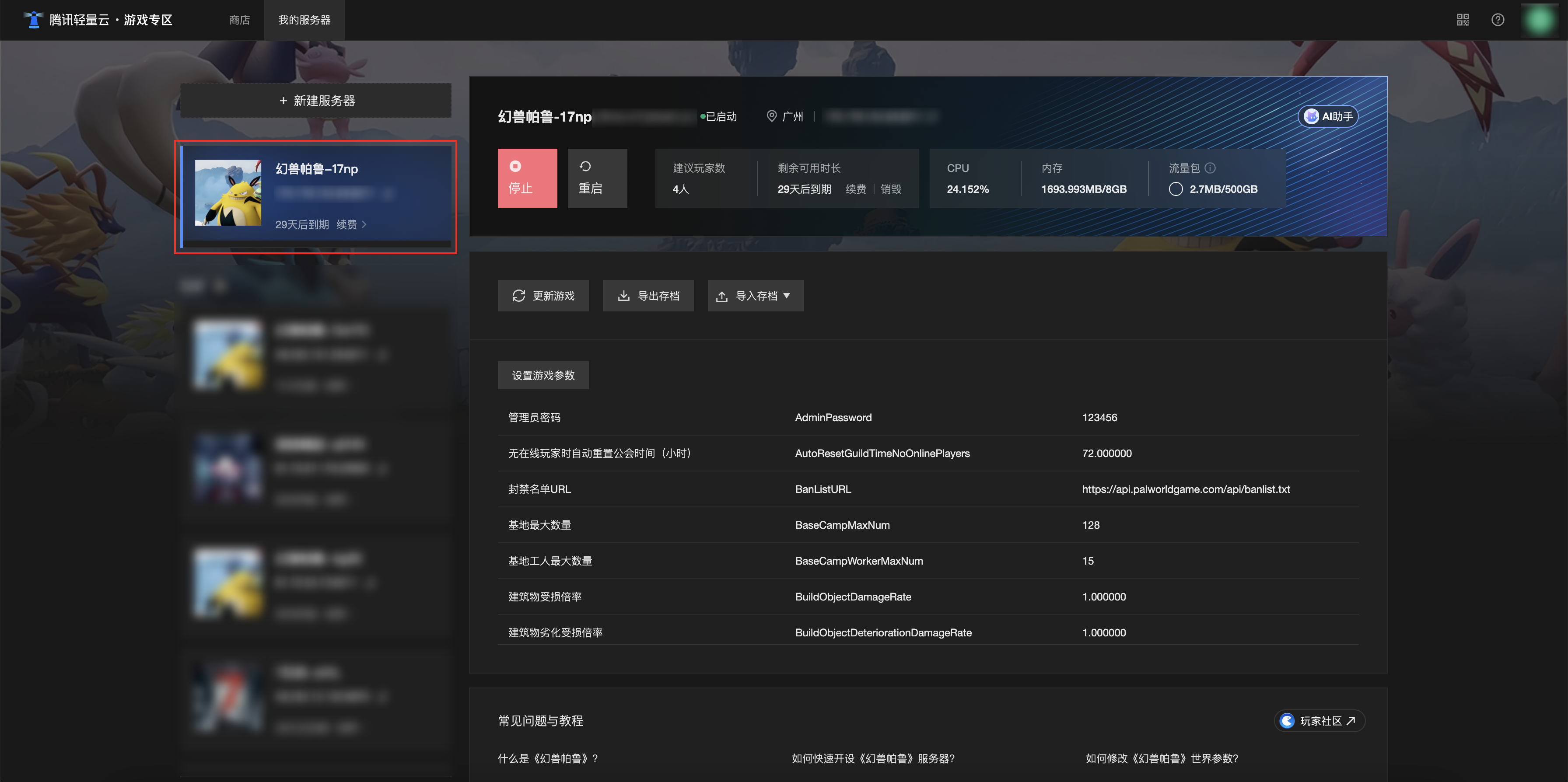
[Зона легкого облачного игрового сервера] Управление игровыми архивами