Может убивать опухолевые клетки in vitro! Команда Beihang «Small» выпустила феррожидкостного робота для фототермической обработки опухолей «окна»
Благодаря своим превосходным способностям к деформации, управляемости и гибкости в методах приведения в действие в последние годы для диагностики и лечения различных заболеваний были разработаны миниатюрные магнитно-мягкие роботы, которые могут достигать точных изменений формы под воздействием внешних магнитных полей.
Среди них роботы на феррожидкости (FR) демонстрируют превосходные способности к деформации благодаря жидкостным свойствам немагнитных материалов, что делает их более широко используемыми в области медицины. Кроме того, в жидкой среде FR проявляет отличные свойства самосборки и сохраняет несмешиваемость. В группах роботов микронного размера FR также может активно или пассивно рассеиваться, что придает ему свойства роботов с групповым управлением. Эта особенность делает FR более универсальным при адаптации к сложным средам in vivo, таким как ветви кровеносных сосудов, и особенно подходит для таргетной терапии.

Рисунок 1
Однако, поскольку при применении роботов на феррожидкости к человеческому телу еще предстоит решить множество ключевых проблем, большинство исследований роботов на феррожидкости проводится in vitro. Как использовать феррожидкости в медицинских целях in vivo, остается огромной проблемой.
Не так давно исследовательская группа Фэн Линя, доцента и руководителя докторантуры Школы машиностроения и автоматизации Бэйханского университета, входящей в «Отличную сотню», опубликовала исследовательскую работу в авторитетном журнале «Small» в этой области. нанонауки. Результаты последних исследований «Биосовместимость на основе феррожидкости» опубликованы в виде статьи. Millirobot для ближнего инфракрасного диапазона II Фототермическая терапия опухоли окна》(Biocompatible Ferrofluid-Based Millirobot for Tumor Photothermal Therapy in Near-Infrared-II Окно) В этом исследовании предлагается метод фототермического лечения опухолей с помощью биосовместимого феррожидкостного робота (BFR). Этот метод заменяет базовую жидкость-носитель магнитной жидкости на биосовместимое растительное масло и обеспечивает целенаправленное управление роботом с магнитной жидкостью с помощью трехмерной электромагнитной системы управления.

Рисунок 2
В этом исследовании исследовательская группа Фэн Линя представилаБиосовместимая магнитная жидкостьробот(BFR)Способ приготовления,Создана система управления трехмерным магнитным приводом, которая может реализовать трехмерный магнитный привод в сложных биологических средах, а затем реализована трехмерная магнитная приводная система магнитной жидкости в сложных биологических средах.,И был подтвержден потенциал робота с магнитной жидкостью для достижения контроля движения кровяной среды и уничтожения опухолей.,Проверенные биосовместимые магнитные жидкостиробот Имеет перспективы применения в лечении рака.。Первым автором статьи является Цзи Иминг, магистрант Школы машиностроения и автоматизации, а автором-переписчиком – профессор Фэн Линь.

Рисунок 3
▍Он обладает биосовместимостью и управляемостью. Как приготовить BFR?
Чтобы использовать FR in vivo для диагностики и лечения заболеваний, он должен обладать хорошей биосовместимостью и управляемостью.
Благодаря своему уникальному устройству, генерирующему магнитное поле, роботы на магнитной жидкости естественным образом деформируются, реконфигурируются, самовосстанавливаются и проводят проводимость, а также демонстрируют высокую степень адаптации к окружающей среде. Ранее было проведено множество исследований о том, как контролировать деформацию FR для адаптации к сложным и изменчивым условиям выполнения, и был достигнут хороший прогресс. Однако прогресс исследований по обеспечению биосовместимости FR не идеален, что накладывает серьезные ограничения на его применение in vivo.
В смежных исследованиях роботов с магнитной жидкостью,В качестве базовой жидкости FR часто используется силиконовое масло или феррожидкость на основе минерального масла.использовать,иЭто также является основным источником биологической токсичности ФР. Эффективным способом решения этой проблемы является использование биосовместимых щелочных растворов.。Поэтому,Выбор учебной группыНаночастицы Fe3O4, олеиновая кислота и растительное масло используются для образования BFR.,А для получения наночастиц Fe3O4 был использован метод соосаждения.
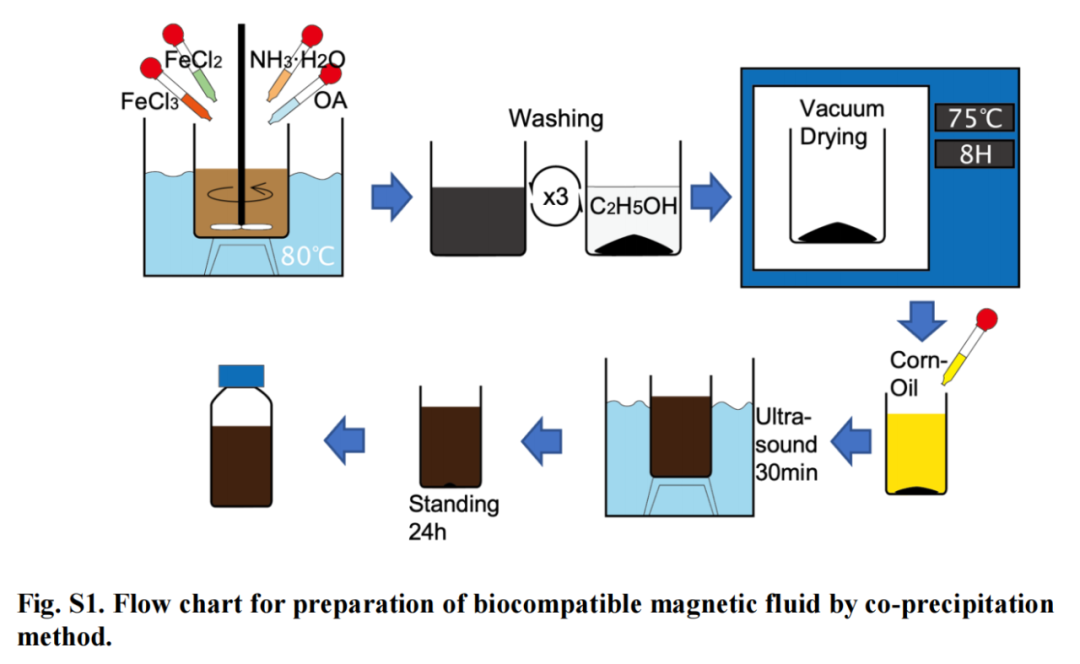
Рисунок 4
В процессе приготовления наночастиц исследовательская группа использовала олеиновую кислоту для покрытия поверхности магнитных частиц. Магнитные частицы, покрытые олеиновой кислотой, были промыты и высушены для получения порошка с магнитными частицами, а также был проведен предварительный скрининг путем растворения парафина. картина 5А показаны данные РФА, где острый пик соответствует Fe3O4 (JCPDS 3–0863) 的微晶。Подготовленные частицы (рис. 5Б) и конечный продукт (рис. 5C) Сравнение данных FTIR показывает, что олеиновая кислота успешно покрывает частицы Fe3O4.насквозь и голыйFe3O4наночастицаFTIRСпектры для сравнения,быть известнымFe3O4Наночастицы покрываются гидроксильными группами в процессе соосаждаемого синтеза.。олеиновой кислотойпокрытый Наночастицы Сравнение FTIR-спектров Fe3O4 показывает, что наночастицы Fe3O4 синтезируются из избытка олеиновой кислоты и образованы двойным слоем олеиновой кислоты. Диаметр наночастиц составляет около 10. nm。
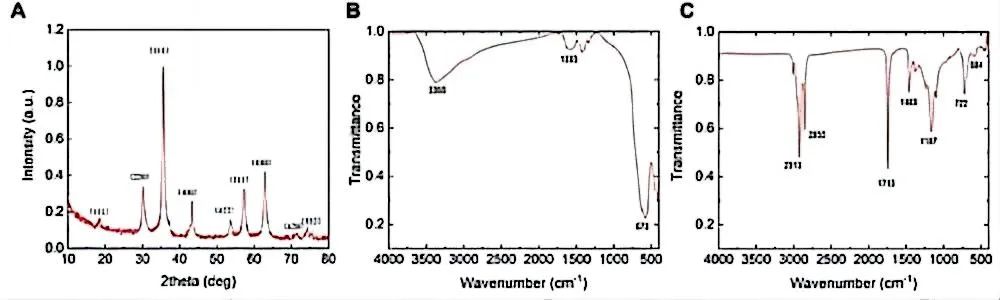
Рисунок 5 A) XRD наночастиц Fe3O4 B) FTIR наночастиц Fe3O4 C) FTIR наночастиц Fe3O4, покрытых ОА;
Смешивая излишки порошка и масла, перемешивая и встряхивая в ультразвуковом очистителе в течение 30 минут, исследовательская группа получила смесь магнитных наночастиц и растительного масла с образованием надосадочной жидкости, которая представляет собой ферромагнитную жидкость на основе растительного масла, необходимую для эксперимента. Ферромагнитная жидкость на основе растительного масла. Жидкость имеет стабильную дисперсию наночастиц Fe3O4 и сочетает свойства жидкости и магнитного контроля.
При проверке процент наночастиц в BFR может достигать 7,8. мас.%, что обеспечивает его деформируемость и управляемость (рис. 6E,Ф). также,Вязкость BFR также меньше меняется при разной напряженности и температуре магнитного поля, что указывает на то, что феррожидкости могут сохранять одинаковые деформационные способности при разных температурах и напряженностях магнитного поля.。

Рисунок 6. D) Результаты просвечивающего электронного микроскопа (ПЭМ) наночастиц в BFR; E) Линия гистерезиса приготовленной феррожидкости. F) Спектр поглощения феррожидкости в УФ-видимом и ближнем инфракрасном диапазоне. G) Температурная кривая различных концентраций BFR при 1064; нм БИК-облучение H) Исследование фототермической стабильности BFR во время пяти процессов нагревания-охлаждения;
в то же время,Наличие наночастиц Fe3O4 также позволяет BFR проявлять фототермические свойства.。Исследовательская группа использует400-1600 Спектр инфракрасного поглощения BFR был получен экспериментом по поглощению нм света. Спектр показывает BFR на уровне 1064. Длина волны инфракрасного излучения в нм демонстрирует высокую скорость поглощения, что согласуется с тем фактом, что 1064 может эффективно убивать опухолевые клетки глубоко в организме во время фототермической обработки. Длина волны лазера в нм остается постоянной.

Рисунок 7. Моделирование фототермического эффекта BFDR. Картина теплового излучения после 5 минут БИК-лазерного облучения (7,8% BFR). (B) Кривая распределения температуры поверхности каждой лунки 24-луночного планшета.
Добавив капли феррожидкости объемом 0,5 мкл с различными концентрациями магнитных частиц в 24-луночный планшет и облучая их источником света с длиной волны 1064 нм в течение 5 минут, исследовательская группа получила кривые цикла нагрева и охлаждения BFR (рис. 6H). Результаты показывают, что существует положительная корреляция между концентрацией наночастиц и повышением температуры, а BFR обладает хорошей фототермической стабильностью.
В результате исследовательская группа получила BFR, который является одновременно биосовместимым и контролируемым.
▍Система с четырьмя электромагнитными катушками генерирует однородное градиентное магнитное поле для достижения точного контроля движения BFR.
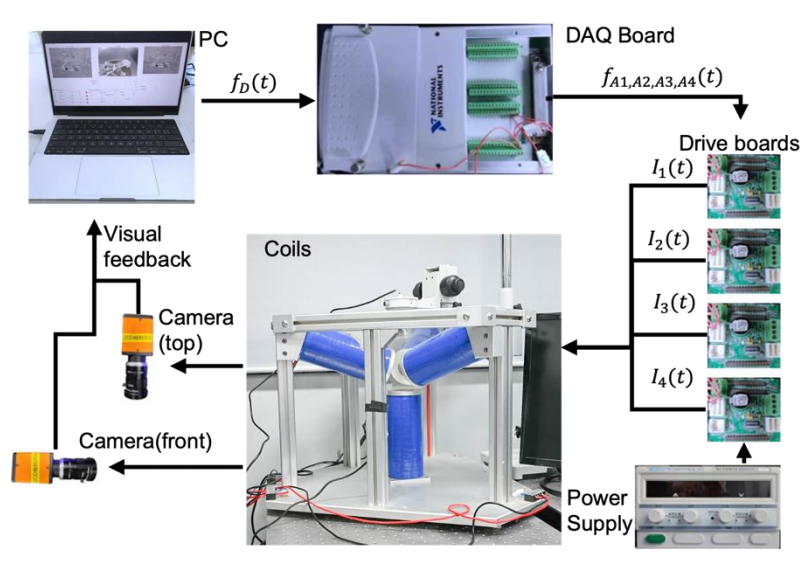
Рисунок 8. Структура системы с четырьмя катушками. Он состоит из шести частей: компьютера, карты данных, накопителя, блока питания, катушки и камеры.
Точность системы управления имеет решающее значение для способности BFR проводить целенаправленную терапию через систему кровообращения.
Робот BFR может использовать градиентные магнитные поля для точного управления движением в жидкой среде. Поэтому исследовательская группа разработала систему с четырьмя электромагнитными катушками, которая может генерировать однородное градиентное магнитное поле для достижения точного управления движением BFR. Подавая на системную катушку различные значения постоянного тока, можно также контролировать скорость перемещения BFR.
В экспериментах in vitro система управления с визуальной обратной связью может управлять движением BFR в любом направлении. Исследовательская группа проанализировала ошибку управления системой, автоматически контролируя движение BFR по треугольной траектории, а также рассчитав и подсчитав ошибку управления. Результаты показывают, что погрешности управления БФР по разным направлениям в целом согласуются, а погрешности автоматического регулирования в основном сосредоточены в районе 0,1 мм.
Видео демонстрация:https://mpvideo.qpic.cn/0bc3j4aaqaaa44abqcvkdvsvat6dbbhqacaa.f10004.mp4?
Рисунок 9 Управление BFR по траектории «А»
Поскольку BFR не смешивается с кровью, исследовательская группа также контролировала его движение в микрожидкостном лабиринте, наполненном кровью, и проверяла его способность к деформации, управляемость и гибкость вождения.

Рисунок 10 BFR Passes Through Narrow Channel by Deformation

Рисунок 11 BFR Passes Through Bifurcation Channel by Splitting
Управляя движением BFR через смоделированный кровеносный сосуд, который внезапно сузился, команда продемонстрировала способность BFR деформироваться и расщепляться через узкий канал.

Рисунок 12 BFR Controlin 3D Vascular Model
Чтобы дополнительно проверить способность BFR перемещаться в сосудистой сети, исследовательская группа использовала 3D-модели простых сосудов тройничного нерва и сложных сосудов воротной вены печени для дальнейшей проверки управляемости движения деформации BFR. Результаты показывают, что BFR могут проходить через более тонкую и сложную сеть разветвленных кровеносных сосудов, становиться меньшими BFR, а затем рекомбинировать, чтобы двигаться к своей цели.

Рисунок 13 BFR Upstream movement
В то же время BFR также может плавать против течения в модели кровеносного сосуда, наполненной кровью, и эту функцию должны выполнять микро-нанороботы, используемые в организме. Эти особенности имеют большой потенциал применения в области таргетной терапии.

Рисунок 14 BFR Controlin 3D Hepatic Portal Vein Model
Чтобы проверить способность BFR двигаться в сложной сосудистой среде и проверить контролируемость движения BFR на неровных поверхностях тканей и плоских поверхностях кровеносных сосудов у реальных животных, исследовательская группа построила 3D-модель, имитирующую воротную вену печени, и ввела BFR в воротную вену печени. Кровеносный сосуд В правом верхнем углу модели BFR расщепляется и деформируется за счет бифуркаций и тонких трубок под контролем градиентного магнитного поля. Эти части в конечном итоге соединяются в левом нижнем углу модели кровеносного сосуда.

Рисунок 15 BFR Control on a Heart Tissue
Рифленые поверхности, такие как внутренняя поверхность сердца, также присутствуют в кровеносных стволах. Поэтому в другом эксперименте in vitro исследовательская группа закрепила блок сердечной ткани на дне стеклянной чашки, наполнила его физиологическим раствором, добавила в воду BFR и поместила его на поверхность сердечной ткани. Под контролем магнитного поля БФР плавно перемещается по бороздкам внутренней поверхности сердца.

Рисунок 16 Ultrasound Localization of BFR in Vessel
Наблюдение за визуализацией очень важно для контроля движения сосудистой системы, и исследовательская группа также подтвердила это. Используя ультразвук 25 МГц для визуализации сосудов сердца крупного рогатого скота и их внутренней среды, ультразвуковая визуализация четко показывает расположение BFR во время контроля движений. Это показывает, что BFR, подготовленный исследовательской группой, имеет хорошую ультразвуковую визуализацию и может локализовать его в сосудистой сети. Это также означает, что можно визуально отслеживать движение BFR в организме, что еще раз доказывает возможность использования BFR в таргетной терапии опухолей за счет эффекта фототермического преобразования.
▍Убить опухолевые клетки? В чем заключается «убийственный» эффект фототермического эффекта BFR?
Что касается того, можно ли использовать фототермический эффект BFR для контролируемого уничтожения раковых клеток, исследовательская группа также экспериментально подтвердила уничтожающие эффекты различных концентраций BFR при различной мощности ближнего ИК-излучения.
В ходе эксперимента по жизнеспособности клеток CCK-8 исследовательская группа пришла к выводу, что феррожидкость на силиконовом масле (EMG901) и феррожидкость на минеральном масле значительно подавляют жизнеспособность клеток, в то время как BFR с концентрацией до 7,8 мас.% не ингибирует жизнеспособность клеток. Это предварительная проверка. робот Биосовместимость BFR еще раз подтвердила его биобезопасность.
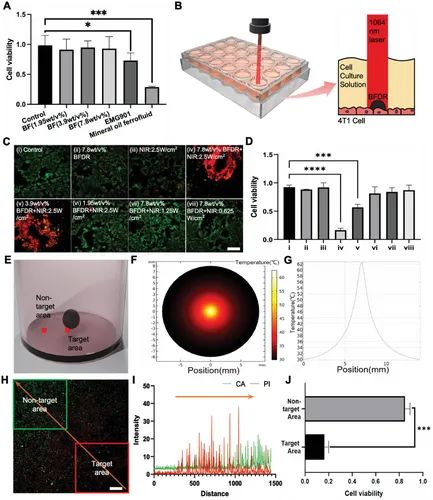
Рисунок 17 A) Феррожидкость, приготовленная (BF) Биосовместимость по сравнению с другими феррожидкостями, обычно используемыми в исследованиях. Б) Схематическая диаграмма фототермического эффекта BFR, убивающего опухолевые клетки. С) Окрашивание живых/мертвых опухолевых клеток (4Т1). Масштаб: 200 µm。D) Жизнеспособность клеток после различных обработок. Е) Концептуальная карта целевых и нецелевых территорий. Ф) Лазерное облучение ближнего инфракрасного диапазона 5e Картина теплового излучения клеточной культуры через несколько минут. Г) Кривая распределения температуры грунта скважины. ЧАС) Схема окрашивания клеток для целенаправленного уничтожения клеток. Масштаб: 500 µm。I) (H) Статистика интенсивности флуоресценции в направлении оранжевой стрелки. Дж) Сравнение жизнеспособности клеток между целевыми и нецелевыми областями.
Пройдите тест на магнитные манипуляции, подвергнувшись воздействию 1064 При стимуляции нанометровым ближним инфракрасным светом BFR может прикрепляться к поверхности клетки и генерировать тепло, убивая окружающие опухолевые клетки (рис. 17Б). Результаты экспериментов показывают, что при 2,5 W cm -2 мощность облучения, 7,8 wt% Эффект термического уничтожения BFR достигает 80%, эффект уничтожения 3,9% масс. BFR достигает 58% (Рисунок); 17 D ). Окрашивание гибели клеток показало аналогичные цитотоксические эффекты. в 2,5 W cm -2 силовая стимуляция, 7,8 и 3,9 wt% BFR убивает все клетки в радиусе действия радиации (Рисунок 17 C)。
Кроме того, исследовательская группа определила целевую контролируемость уничтожения опухоли на основе фототермической кривой BFR (рис. 17Е). По результатам моделирования температура БФР постепенно снижается от центра к периферии (Рисунок 17 Ф, Г). Это фототермическое распределение может привести к той же тенденции гибели опухолевых клеток, то есть гибель опухолевых клеток снижается по градиенту от центральной области BFR к окружающей области (Рисунок); 17 ПРИВЕТ). Уровень смертности опухолевых клеток в районах без покрытия BFR был значительно ниже, чем в районах, охваченных BFR (рис. 17Дж). Эти данные доказывают, что фототермическое распределение можно контролировать, контролируя положение BFR, тем самым достигая контролируемого уничтожения опухолевых клеток.
В ходе дальнейших экспериментов in vivo приведенные выше экспериментальные выводы были дополнительно подтверждены на мышах с опухолями 4T1.
Во время лечения опухолей у мышей с опухолями 4T1 на основе фототермического эффекта BFR исследовательская группа регистрировала объем опухоли у мышей.
По сравнению с контрольной группой, у всех мышей, обработанных ближним инфракрасным излучением, развились пятна ожогов различной степени. ФДДР+МАГ Опухоли в группе лечения NIR подавлялись более значительно, чем в других группах (Рисунок 18 А), а объем опухоли на 3-е и 6-е сутки после лечения был на 56,73% и 67,48% меньше, чем в контрольной группе соответственно (Рисунок 18 C)

Рисунок 18 Анализ уничтожения опухолей in vivo. А) Статус опухоли у голых мышей в каждой экспериментальной группе после шести дней лечения Б) Весовая кривая С) кривая размера опухоли;D)обращаться6Статистика объема опухолевой ткани, выделенной из Тяньхоу;E)Срезы опухолей, собранные у мышейH&EРезультаты окрашивания。шкала:50 µ m;F,G) Результаты окрашивания TUNEL и KI67 срезов опухоли. Черное фоновое изображение представляет собой флуоресцентное изображение, а белое фоновое изображение представляет собой характерное флуоресцентное изображение. Масштаб: 100 µ m。
После 6 дней лечения, хотя существенной разницы в массе тела мышей в каждой группе не было (рис. 18Б). Однако после того, как мышей подвергли эвтаназии и вырезали опухолевую ткань, было обнаружено, что изолированная опухолевая ткань была меньше, чем опухолевая ткань во всех других группах, и демонстрировала явные признаки некроза. Объем изолированной опухолевой ткани в NIR+. В группе BFR+MAG было значительно меньше, чем в других группах, снижение на 70% по сравнению с контрольной группой (Рисунок). 18 D)。
Срезы опухолевой ткани, окрашенные гематоксилином и эозином.,по сравнению с другими группами,Опухолевые клетки в группе NIR+BFR+MAG были редкими и сопровождались некрозом. Окраска PB срезов опухолевой ткани показывает,Больше накапливается в опухолевой ткани под действием магнитного поляBFR(Рисунок 18 Е). Результаты окрашивания TUNEL показали, что скорость апоптоза клеток в группе NIR+BFR+MAG была значительно выше, чем в других группах (Рисунок 18 Е). Напротив, индекс пролиферации опухолевых клеток в группе NIR+BFR+MAG был значительно ниже, чем во всех других группах (Рисунок 18 F)。
На основании этих данных есть основания полагать, что BFR, разработанный в этом исследовании, может воздействовать на опухолевую ткань под контролем магнитного поля, генерировать тепло для уничтожения опухолевых клеток и ингибировать пролиферацию опухолевых клеток под воздействием ближнего инфракрасного излучения.
Этот результат исследования не только обеспечивает новую точку прорыва в доставке лекарств и лечении опухолей в сложном кровообращении, но также дает основу для таргетной терапии in vivo на основе микророботов с феррожидкостью.
▍Заключение
Стоит отметить, что ранее исследовательская группа под руководством профессора Фэн Линя также предложила стратегию доставки лекарств под названием «Троянский конь» и разработала нового микро-наноробота «Макрофагальный робот». Используя макрофаги в качестве носителей для загрузки лекарств, убивающих опухоли, робот-макрофаг может избежать иммунного отторжения в организме и точно доставить лекарства к конкретным тканям или органам, обеспечивая контролируемое высвобождение лекарств под действием ближнего инфракрасного света. точно устранить опухоли.
Соответствующая статья была также опубликована в журнале «Small» под заголовком «Точный контроль индивидуальных роботов из макрофагальных клеток для таргетной терапии солидных опухолей с минимальной инвазивностью».

Рисунок 19
Микро-нанороботы, изготовленные из биосовместимых материалов, таких как полимеры, липосомы или наночастицы, могут переносить лекарства и доставлять их непосредственно к месту опухоли с помощью физических или химических средств, тем самым улучшая терапевтический эффект и уменьшая побочные эффекты. Они обладают большим потенциалом для точного нацеливания на опухоль. и доставка лекарств.
Хотя эта технология предполагает манипулирование наноразмерами, такие вопросы, как безопасность, стабильность и стоимость производства, все еще требуют дальнейшего решения, а ее применение в лечении опухолей все еще находится в зачаточном состоянии.
Но благодаря исследованиям и разработкам все большего числа команд и компаний, возможно, в ближайшем будущем мы сможем достичь истинно точной медицины, сочетая микро-нанотехнологии с лечением опухолей.
Справочная статья:
https://onlinelibrary.wiley.com/doi/10.1002/adhm.202302395
Набор текста |

Неразрушающее увеличение изображений одним щелчком мыши, чтобы сделать их более четкими артефактами искусственного интеллекта, включая руководства по установке и использованию.
Копикодер: этот инструмент отлично работает с Cursor, Bolt и V0! Предоставьте более качественные подсказки для разработки интерфейса (создание навигационного веб-сайта с использованием искусственного интеллекта).
Новый бесплатный RooCline превосходит Cline v3.1? ! Быстрее, умнее и лучше вилка Cline! (Независимое программирование AI, порог 0)

Разработав более 10 проектов с помощью Cursor, я собрал 10 примеров и 60 подсказок.
Я потратил 72 часа на изучение курсорных агентов, и вот неоспоримые факты, которыми я должен поделиться!
Идеальная интеграция Cursor и DeepSeek API
DeepSeek V3 снижает затраты на обучение больших моделей
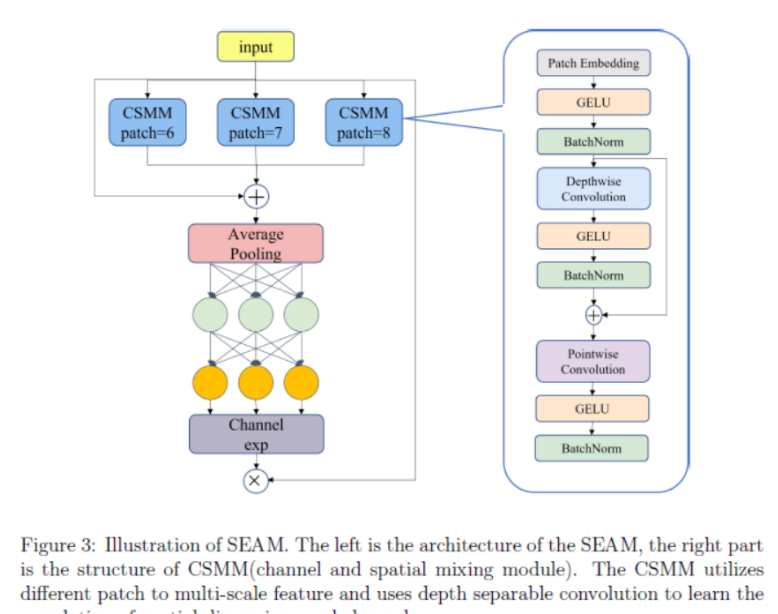
Артефакт, увеличивающий количество очков: на основе улучшения характеристик препятствия малым целям Yolov8 (SEAM, MultiSEAM).

DeepSeek V3 раскручивался уже три дня. Сегодня я попробовал самопровозглашенную модель «ChatGPT».

Open Devin — инженер-программист искусственного интеллекта с открытым исходным кодом, который меньше программирует и больше создает.
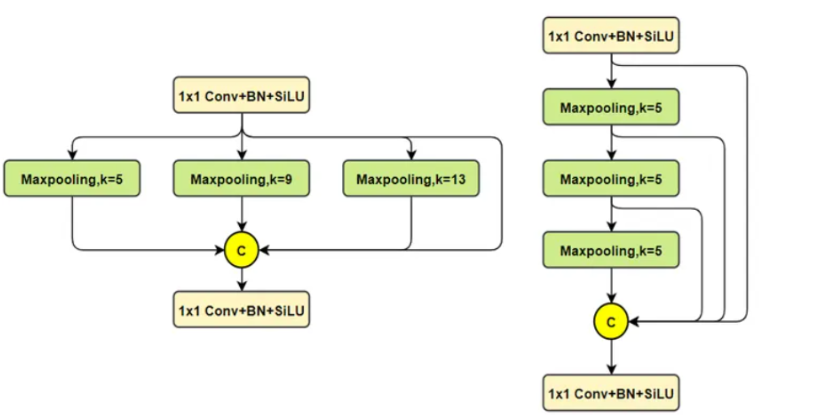
Эксклюзивное оригинальное улучшение YOLOv8: собственная разработка SPPF | SPPF сочетается с воспринимаемой большой сверткой ядра UniRepLK, а свертка с большим ядром + без расширения улучшает восприимчивое поле

Популярное и подробное объяснение DeepSeek-V3: от его появления до преимуществ и сравнения с GPT-4o.

9 основных словесных инструкций по доработке академических работ с помощью ChatGPT, эффективных и практичных, которые стоит собрать
Вызовите deepseek в vscode для реализации программирования с помощью искусственного интеллекта.
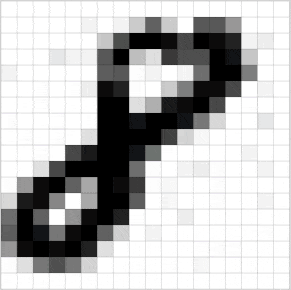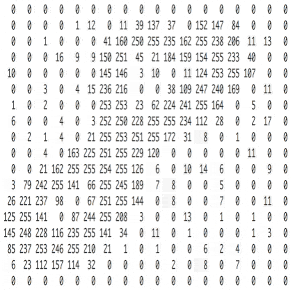
Познакомьтесь с принципами сверточных нейронных сетей (CNN) в одной статье (суперподробно)
50,3 тыс. звезд! Immich: автономное решение для резервного копирования фотографий и видео, которое экономит деньги и избавляет от беспокойства.
Cloud Native|Практика: установка Dashbaord для K8s, графика неплохая
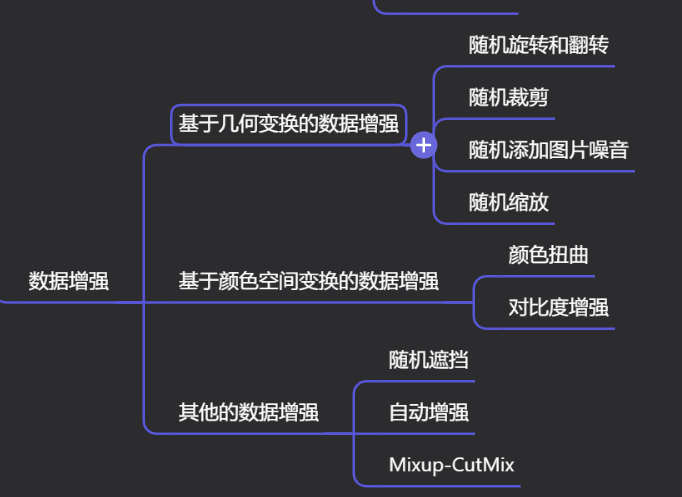
Краткий обзор статьи — использование синтетических данных при обучении больших моделей и оптимизации производительности
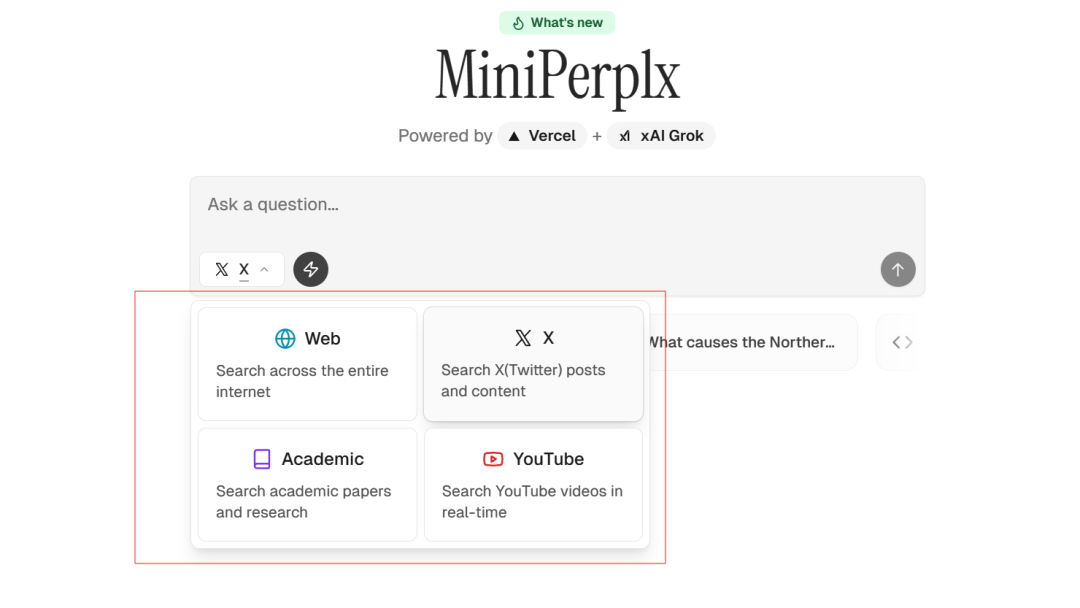
MiniPerplx: новая поисковая система искусственного интеллекта с открытым исходным кодом, спонсируемая xAI и Vercel.
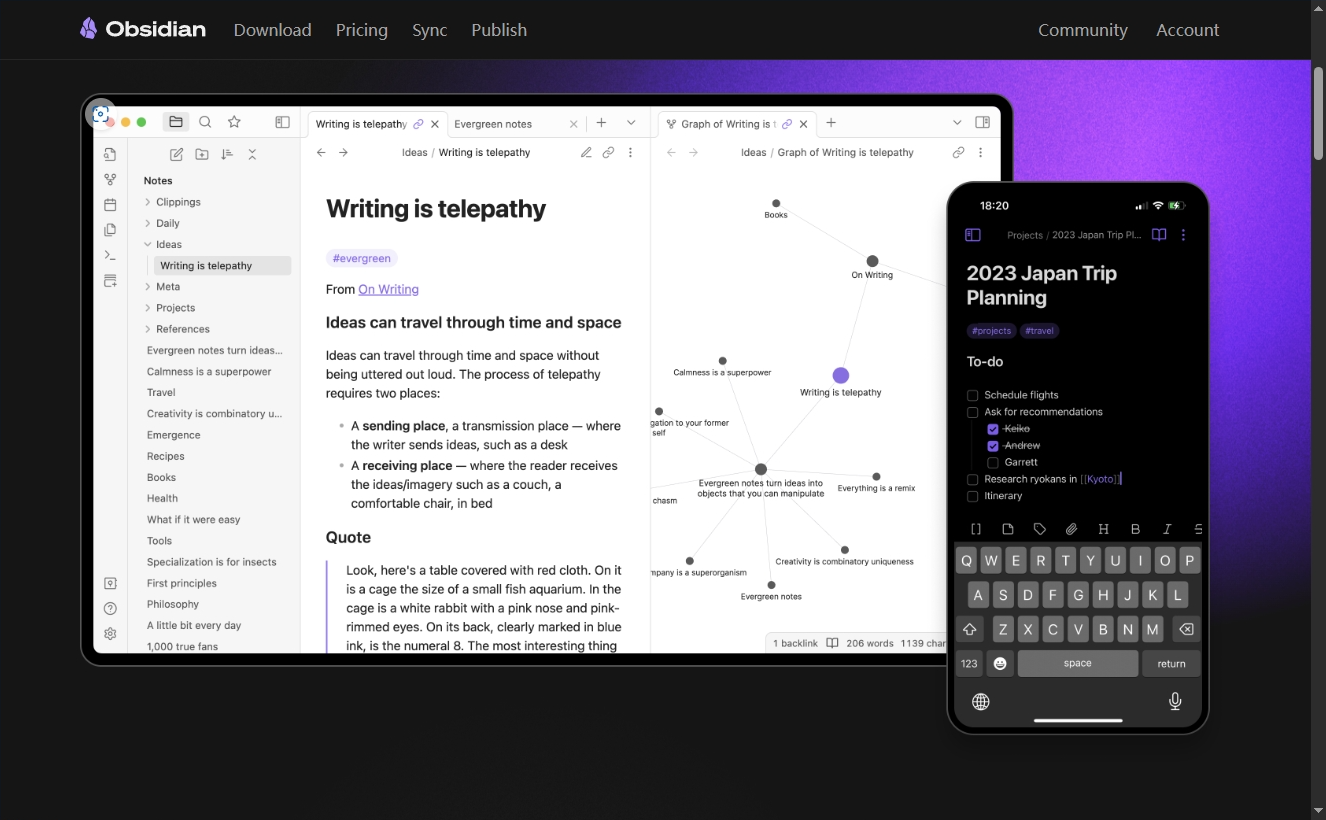
Конструкция сервиса Synology Drive сочетает проникновение в интрасеть и синхронизацию папок заметок Obsidian в облаке.
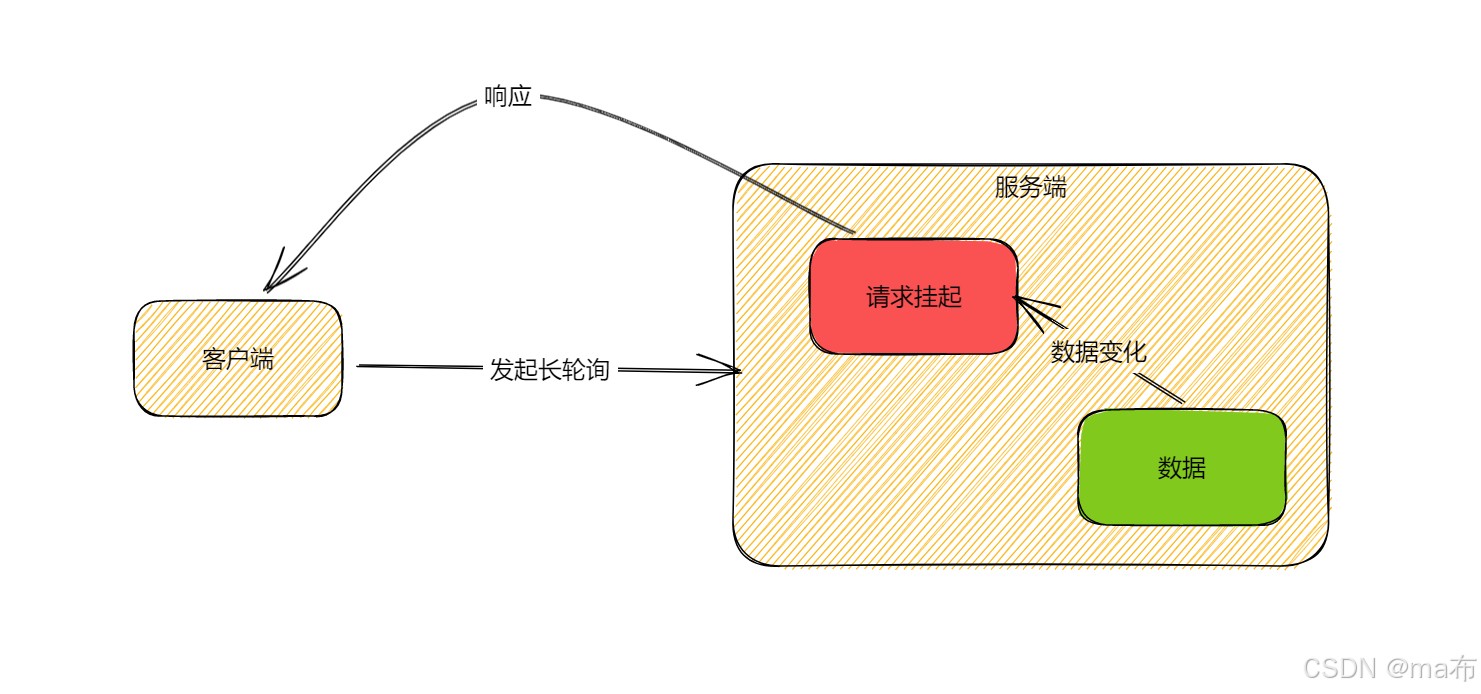
Центр конфигурации————Накос
Начинаем с нуля при разработке в облаке Copilot: начать разработку с минимальным использованием кода стало проще

[Серия Docker] Docker создает мультиплатформенные образы: практика архитектуры Arm64

Обновление новых возможностей coze | Я использовал coze для создания апплета помощника по исправлению домашних заданий по математике

Советы по развертыванию Nginx: практическое создание статических веб-сайтов на облачных серверах
Feiniu fnos использует Docker для развертывания личного блокнота Notepad

Сверточная нейронная сеть VGG реализует классификацию изображений Cifar10 — практический опыт Pytorch
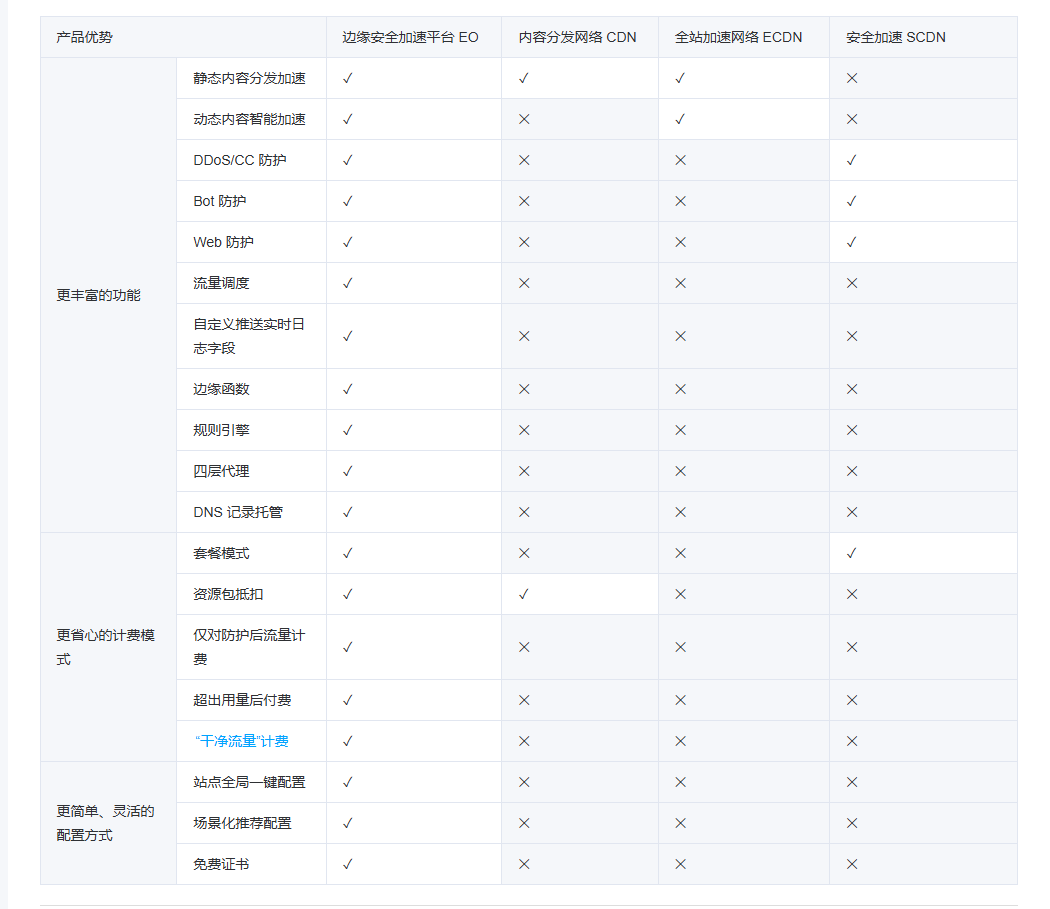
Начало работы с EdgeonePages — новым недорогим решением для хостинга веб-сайтов
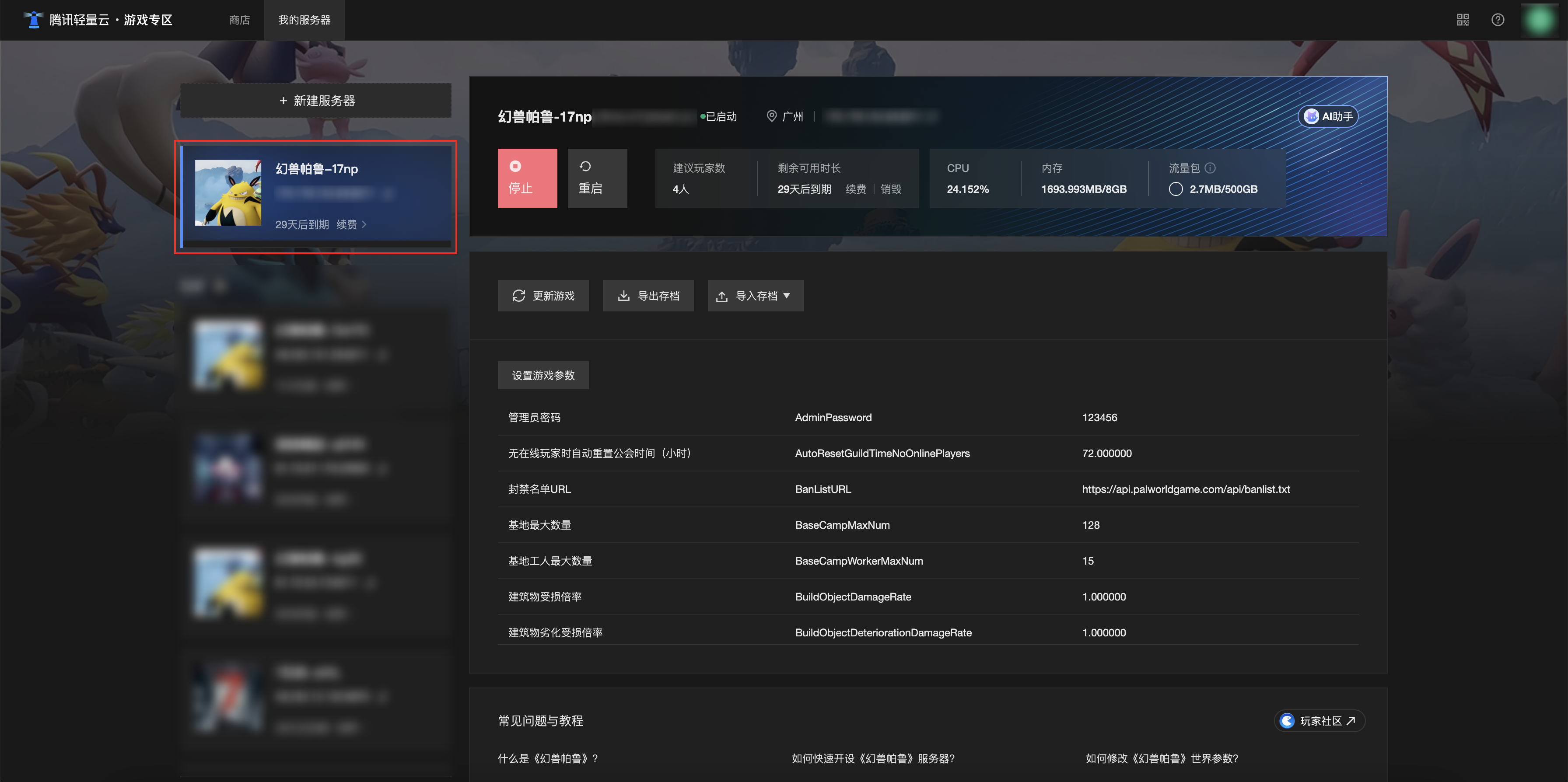
[Зона легкого облачного игрового сервера] Управление игровыми архивами