Интеграция данных об одноклеточных и объемных РНК позволяет определить ключевые типы клеток и биомаркеры сердечной недостаточности.
Обзор статьи
Основная информация
Название статьи: Ключевые типы клеток и биомаркеры при сердечной недостаточности, выявленные посредством анализа данных секвенирования одноклеточных и групповых РНК [Интеграция данных об одноклеточных и массовых РНК для идентификации ключевых типов клеток и биомаркеров при сердечной недостаточности]
Время публикации: 2023-12-26
Опубликовано в журнале: Медиаторы воспаления.
Импакт-фактор: 3,578
Ссылка для онлайн-чтения:
https://www.hindawi.com/journals/mi/2023/8384882/
Аннотация статьи
Актуальность: Сердечная недостаточность (СН) — сложный клинический синдром, обусловленный различными заболеваниями сердца, и представляет собой серьезную медицинскую проблему во всем мире. Хотя роль воспаления в патогенезе СН хорошо известна, конкретные типы клеток и участвующие в нем регуляторные молекулы остаются плохо изученными.
Методы и результаты. Авторы определили ключевые типы клеток и новые биомаркеры, анализируя данные секвенирования одноклеточных и объемных РНК у пациентов с двумя основными типами СН: ишемической кардиомиопатией и дилатационной кардиомиопатией. Миелоидные клетки были идентифицированы как первичная клеточная популяция, участвующая в СН, посредством анализа клеточной фракции и обогащения набора генов. Дифференциальный анализ миелоидных клеток выявляет перекрестные помехи между клеточной коммуникацией и цитокиновой регуляцией иммунных ответов при СН, при этом путь MIF становится ключевым путем иммунорегуляции. Рецепторный комплекс CD74/CXCR4 значительно активируется в субпопуляции миелоидных клеток Mφ2 и может служить ключевым регулятором при СН. После получения сигнальных молекул MIF рецептор CD74/CXCR4 может активировать передачу сигналов NF-κB для выработки хемокинов, тем самым усиливая воспалительную реакцию.
Выводы: CD74 и CXCR4 могут служить биомаркерами и терапевтическими мишенями при СН.
Введение болезней и разработка экспериментов
Занесение болезни
Сердечная недостаточность (СН) — сложный клинический синдром, при котором нарушается функция сердца, что приводит к ухудшению способности перекачивать кровь и неспособности удовлетворить метаболические потребности организма. Сердечная недостаточность обычно является конечной стадией различных сердечно-сосудистых заболеваний и может быть обусловлена различными заболеваниями сердца, среди которых основными причинами являются ишемическая кардиомиопатия (ИКМ) и дилатационная кардиомиопатия (ДКМП). Пациенты с СН получают индивидуальные и точные стратегии лечения, основанные на классификации ФВЛЖ (фракция выброса левого желудочка), что требует более глубокого понимания патофизиологии СН и связанных с ней транскриптомных и генетических механизмов.
Ранние исследования показали, что несбалансированное воспаление играет решающую роль в патофизиологии сердечной недостаточности, при этом моноциты и макрофаги играют решающую роль в поддержании сердечного гомеостаза и иммунной защиты. Макрофаги могут поляризоваться на фенотип М1 с провоспалительными способностями или на фенотип М2 с противовоспалительными способностями. Плохое ремоделирование левого желудочка из-за перегрузки давлением требует сердечных макрофагов, происходящих из CCR2 + моноцитов. Эти анализы показывают, что функционально гетерогенные субпопуляции макрофагов находятся в иммунном микроокружении сердца и способствуют развитию СН. Однако конкретные механизмы и задействованные субпопуляции макрофагов неясны.
Секвенирование одноклеточной РНК (scRNA-seq) позволяет изучить популяции клеток, участвующие в HF, на молекулярном уровне и изучить, как взаимодействия между различными субпопуляциями клеток регулируются рецептором-лигандом (L-R). Исследования сердечно-сосудистой иммунной микросреды у мышей с перегрузкой давлением показывают, что иммунная активация включает в себя несколько типов клеток. Например, макрофаги CD72 hi высвобождают провоспалительные факторы, приводящие к повреждению сердца, что позволяет предположить, что воздействие на макрофаги CD72 hi может быть новой терапевтической стратегией при СН. Для пациентов с СН также были созданы атласы отдельных клеток высокого разрешения для анализа популяций иммунных клеток, но размер выборки был небольшим, что ограничивало объем анализа. Здесь ключевые типы клеток и гены, специфичные для типа клеток, которые играют важную роль в патогенезе СН, выясняются посредством совместного анализа данных сек РНК scRNA и объемных данных секвенирования РНК.
образец
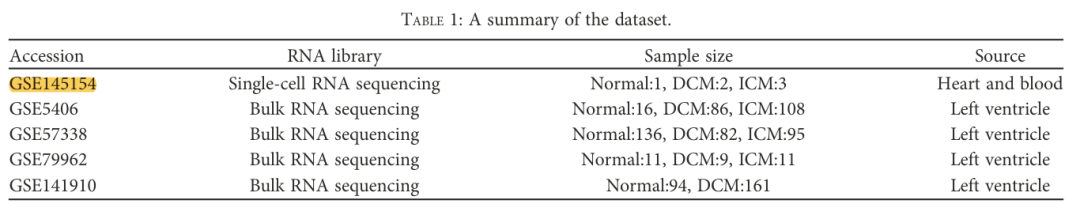
- Набор данных одноклеточной РНК-секвенирования (GSE145154) из сердца и крови содержит 1 нормальный образец.、2 образца DCM и 3 образца ICM.
- Три объемных набора РНК-секвенаторов включают нормальный, DCМиICMобразец: GSE79962, GSE5406 и GSE57338.
- GSE141910данныенабор,Включает DCM и обычный образец, а также записанную информацию изLVEF.,Для дальнейшего анализа и проверки.
Блок-схема анализа
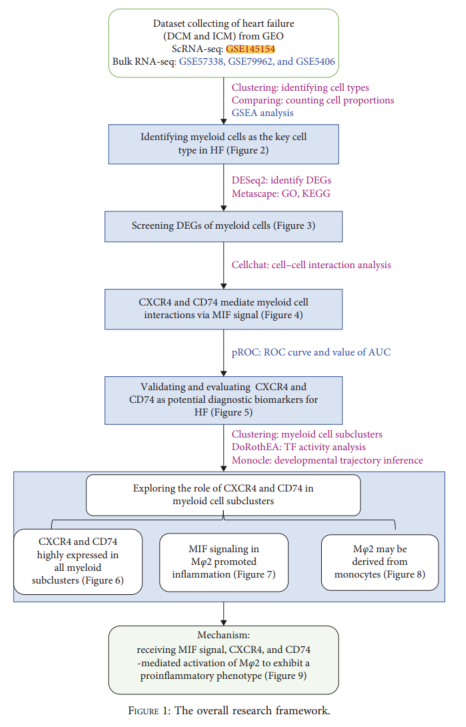
Был проведен биоинформатический анализ образцов HF, содержащих ICM и DCM (рис. 1), для изучения ключевых типов клеток, участвующих в HF, и выявления потенциальных биомаркеров.
- Сначала миелоидные клетки, участвующие в HFиз, были идентифицированы с помощью scRNA-секвенированных серединаиз-кластерного анализа.,определить типы клеток,Сравните клеточные компоненты разных групп.,и выполнил анализ обогащения набора генов (GSEA) с использованием объемной секвенации РНК.
- Затем,проанализировано Костный мозг в каждой группеклетка издифференциальное выражение,И мы использовали Metascape, чтобы изучить дифференциальную экспрессию серединаизовых функций этих генов.
- верно Клеточные взаимодействия Дальнейший анализ показал,Сигнальный путь MIF серединаизмолекулы существующегоHFсередина значительно активировался.,И могут иметь ценные биомаркеры.
- наконец,Рекластеризация клеток костного мозга с более высоким разрешением,Изучить гетерогенность подтипов миелоидных клеток и их потенциальные дифференцировочные взаимоотношения.
Результаты исследования
Одноклеточный атлас выявил гетерогенность иммунных клеток у пациентов с СН
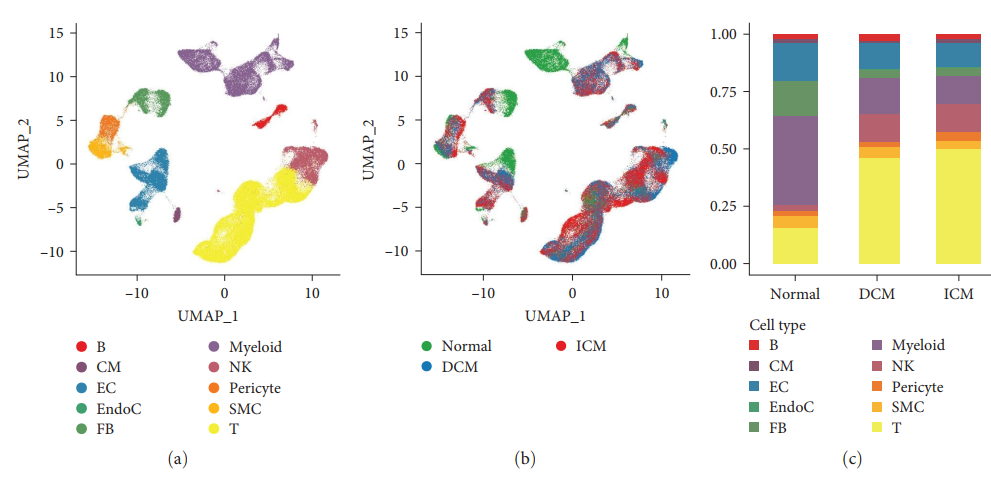
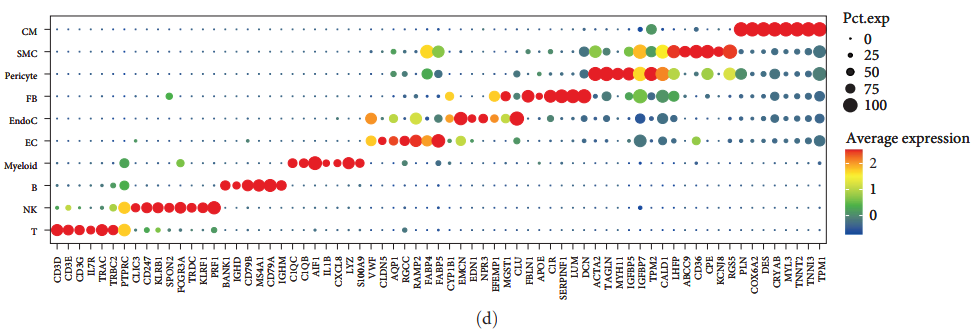
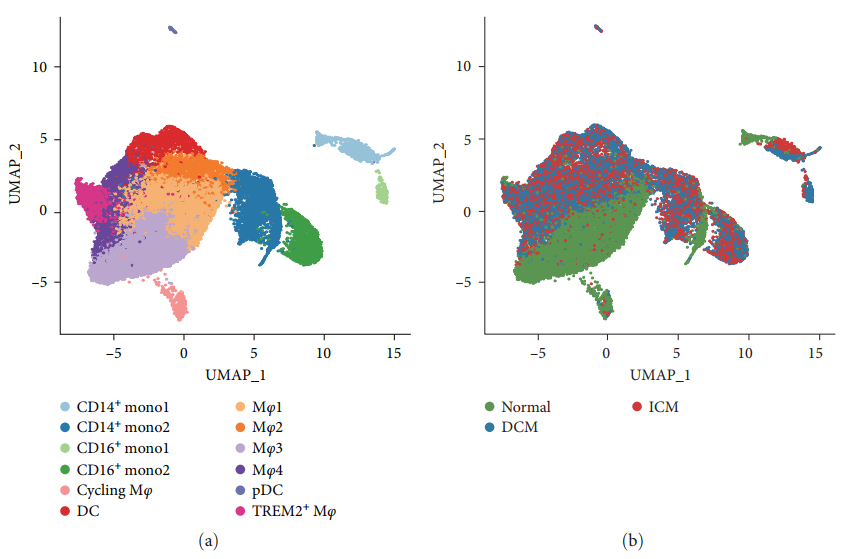
Авторы сначала сравнили различия между здоровыми людьми и пациентами с СН, используя наборы данных scRNA-seq. После строгого контроля качества 126 667 клеток были сохранены и классифицированы на 25 кластеров с использованием UMAP и кластерного анализа. Путем оценки наличия и распространенности генов классических клеточных сигнатур в каждом кластере было идентифицировано 10 кластеров клеток (рис. 2 (а)) и три типа образцов (рис. 2 (б)). Затем были использованы точечные графики для описания уровней экспрессии характерных маркеров для каждого из 10 кластеров. Эти кластеры были идентифицированы как (рис. 2(d)):
- T клетки (CD3D, CD3E и CD3G)
- естественный убийца (NK) клетки (FCGR3A и KLRB1)
- B клетки (CD79A, CD79B и BANK1)
- Миелоидные клетки (LYZ, C1QC и C1QB)
- эндотелиальные клетки (EC)(VWF、TAGLN и CLDN5)
- эндокардиальные клетки (LUM и DCN)
- фибробласты (FB)(LUM и DCN)
- Перициты (VWF, TAGLN и CLDN5)
- Гладкостмышечные клетки (ГМК) (MYH11)
- Кардиомиоциты (MYH7иMYL2)
Затем в соответствии с соответствующим источником выборки (обычный, DCM и ICM) в трех цветах (зеленый, синий и красный) верно 10 Кластеры клеток окрашены [картина 2(б)]. Как показано на рисунке 2(b), распределение клеток DCMсерединаиз аналогично распределению клеток ICMсерединаиз. Однако клеточный состав здоровых людей отличается от такового у больных сердечной недостаточностью. Кроме того, анализируя каждую группу образцов 10 Процент обнаруженных кластеров клеток HF образециз Процент ЭК и фибробластамиелоидных клеток был значительно снижен, в то время как T клетка и NK Процент клеток значительно выше [картина 2(c)]。
Далее, верно scRNA-seq и bulk RNA-seq Данные (GSE79962, GSE5406 и GSE57338) провел систематический анализ для дальнейшего выявления HF Родственные типы клеток. потому что HF Количество клеток костного мозга у больных значительно снижено, поэтому в bulk Данные были централизованы GSEA Изучить обогащение маркеров миелоидных клеток. Стоит отметить, что ДКМ и ICM Гены, активность которых снижена, показали значительное обогащение маркерных генов из миелоидных клеток (см. Дополнительный материал). 1)。
Анализ дифференциальной экспрессии генов миелоидных клеток при профилировании экспрессии отдельных клеток
Статья середина Идентификация и сравнение путем проведения дифференциального анализа экспрессии генов DCM/ICM Нарушенная регуляция генов в миелоидных клетках по сравнению с нормальным контролем для изучения HF потенциальные дисфункциональные механизмы. существовать DCM Значительно дифференциально экспрессирующиеся гены были идентифицированы у 275 увеличение 185 гены с пониженной регуляцией [картина 3(а)]. существовать ICM Средний, 163 и 105 гены значительно повышали и понижали активность соответственно. [картина 3(а)]. Кроме того, в DCM и ICM Среди дифференциально экспрессируемых генов в общей сложности 136 общих генов были идентифицированы как положительно регулируемые, из которых 92 имеют пониженную экспрессию (рис. 3(b)). Эти гены связаны с DCM и ICM вызвано HF Общие изменения, связанные с (см. дополнительный материал) 2)。
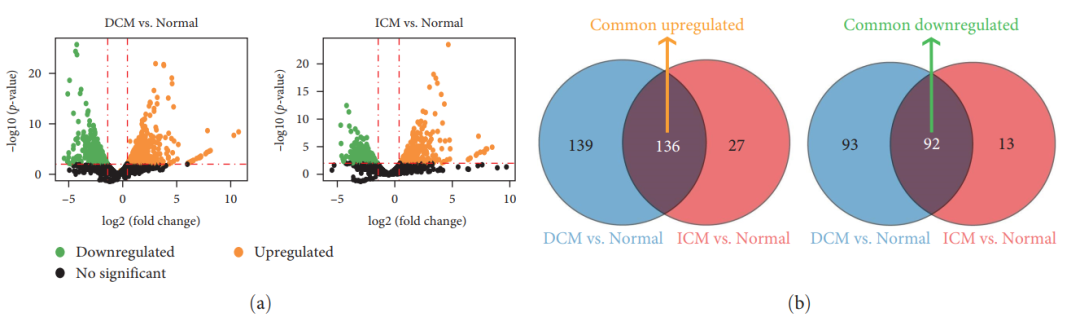
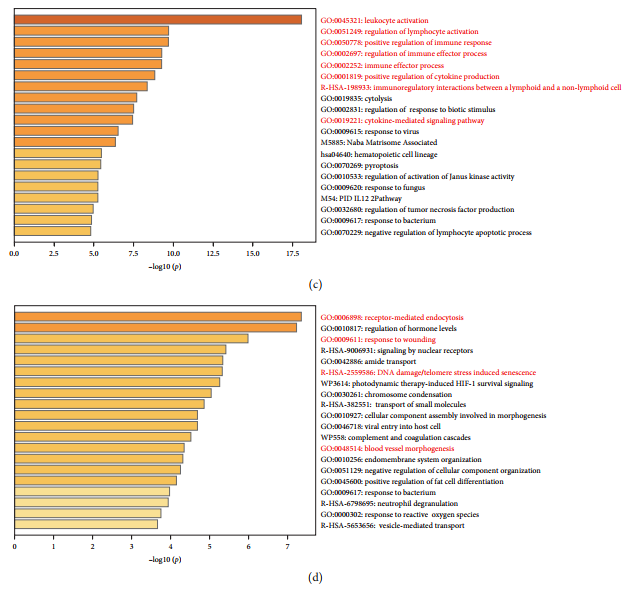
чтобы раскрыть HF Молекулярные механизмы, участвующие в , авторы используют Metascape часто встречается в миелоидных клетках DEG 进行了功能富набор分析。дисплей анализа,136 генов с повышенной регуляцией были значительно обогащены путями, связанными с воспалительной реакцией.,Такие как активация лейкоцитов, регуляция активации лимфоцитов、Положительная регуляция иммунного ответа、Регуляция иммунного эффекторного ответа、иммунный эффекторный процесс、Положительная регуляция продукции цитокинов、Лимфатическая клетка и非лимфа细胞междуиз Иммуномодулирующие взаимодействия и цитокиновое опосредованиеизпроход сигнала(картина3(c))。В сравнении,92гены с пониженной регуляциейсуществовать Пути устранения поврежденийсерединапоказывать Существенноиз富набор,Например, рецептор-опосредованный эндоцитоз.,верно Травма из-за реакции,Повреждение ДНК/стресс теломер индуцирует старение сосудов и морфогенез [картина3(d)].
Сигнальные пути и роль ключевых факторов во взаимодействиях миелоидных клеток
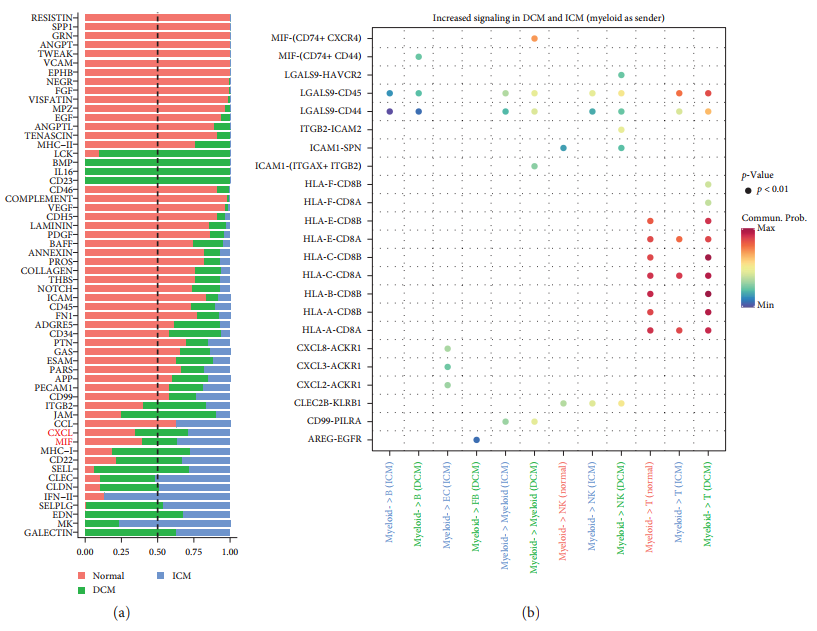
Для прогнозирования миелоидаклетка имежду другими клеткамиизмежклеточные взаимодействия,Авторы связали эти клеточные популяции на основе уровней экспрессии лигандов и взаимодействия с соответствующими рецепторами. использовать Cellchat R пакет для вывода о передаче сигналов, специфичных для клеток, и для трех групп (нормальная, DCM и ICM) создано Cellchat объекты для выявления важных сигналов в каждой группе. Анализ интеграции сигналов привел к 58 пути со значительным взаимодействием [картина 4(а)]. Используя миелоидные клетки в качестве отправителей сигналов, можно выделить три типа CXCL взаимодействие CXCL8-ACKR1、CXCL3-ACKR1 и CXCL2-ACKR1существоватьICMсередина усиливала миелоид и ЭК между изкоммуникацией [картина4(b)].
существоватьDCMиICMсередина,Когда миелоидные клетки служат приемниками, сигнал значительно усиливается.,Включает МИФ,IL16,MHC-II,CXCLиCD99(картина4(c)). Обнаружить MIF Сигнал идентифицируется как получатель или отправитель сигнала.
также,наблюдаемая иммунная клетка иклетки костного мозгасуществоватьMHC-II(HLA-DR、HLA-DP、HLA-DO、HLA-DQиHLA-DM)иCD4междувзаимодействие Аспекты существуютсуществовать Существенно差异。клетки костного мозга通过 CXCR4 и CXCL12 и стромальные клетки (EC, SMC ифибробласты) взаимодействие. ЛГАЛС9-CD45/CD44 верновзаимодействиесуществовать ICM и DCM был улучшен в , но не в элементах управления.
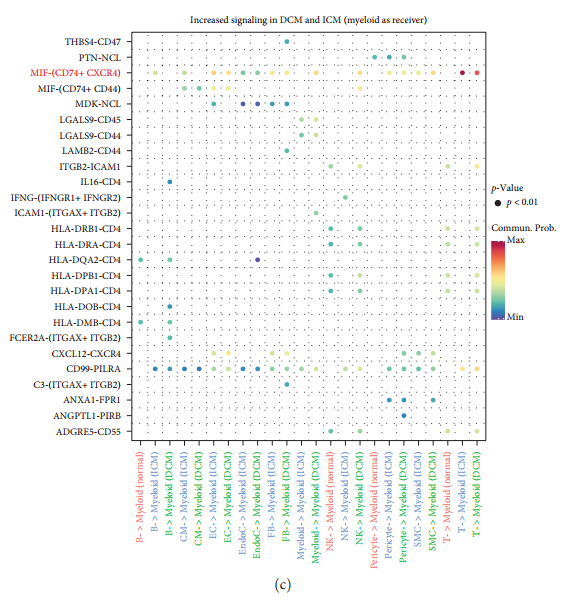
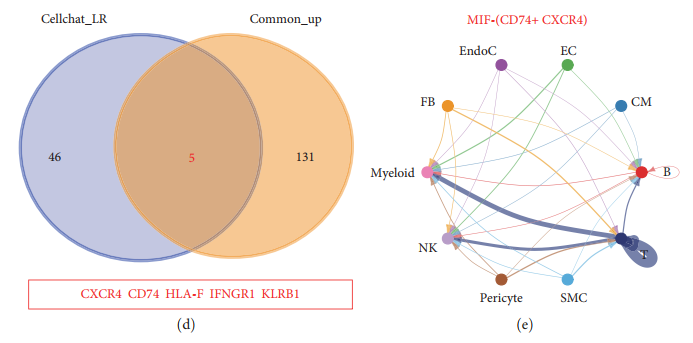
Автор будет DCM и ICM Спаренные гены в миелоидных клетках пациента и CellChat Идентифицированные лиганды рецепторов пересеклись и были обнаружены CXCR4、CD74、HLA-F、IFNGR1 и KLRB1 Эти пять молекул были значительно активизированы (рис. 4(г)). Среди этих молекул CD74 и CXCR4 синергия сформировалась MIF Рецепторный комплекс. Вышеупомянутая сеть взаимодействия сигнального пути (MIF), такая как Рисунок 4(д) показано, что указывает на то, что все другие клетки, особенно Т-клетки, могут взаимодействовать с миелоидными клетками через молекулу MIF-CXCR4+CD74.
Оценка диагностической эффективности CXCR4 и CD74
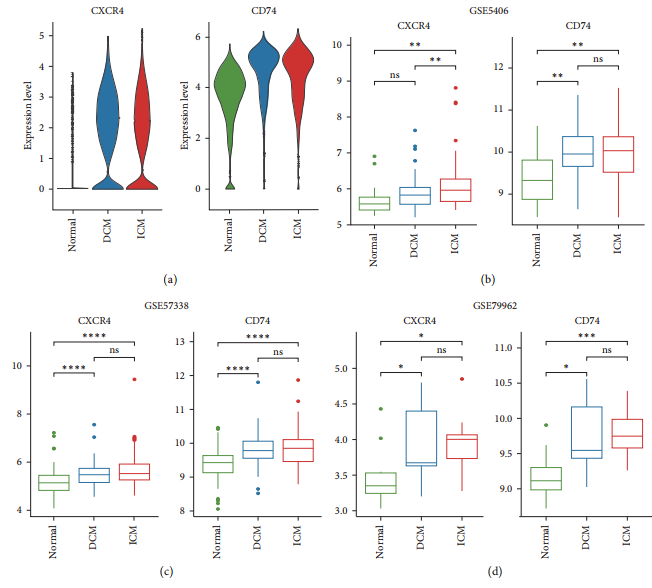
Чтобы изучить регуляторную роль передачи сигналов MIF в прогрессировании СН, авторы CXCR4+CD74 верифиген MIFiz был проанализирован GOizBP. Результаты показывают, что сигнальные молекулы MIF в основном участвуют в регуляции хемотаксиса и регулируются NF-κB1 и RELA (дополнение 3). scRNA-секвенирование показало, что уровни экспрессии CXCR4иCD74из были значительно повышены в миелоидных клетках, полученных из DCMиICMиз [картина5(a)]. Кроме того, существование содержит DCM、ICM Обычный образецизбольшого набора середина подтвердил этот результат. По сравнению с нормальной группой авторы наблюдали DCM и ICM середина CXCR4 и CD74 последовательно увеличивались, в то время как ICM и DCM Существенных различий между [картина 5(b)– 5(d))。
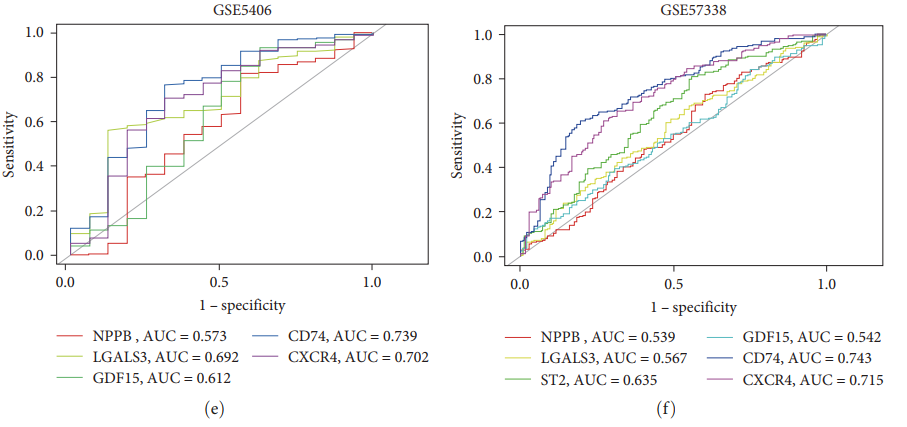
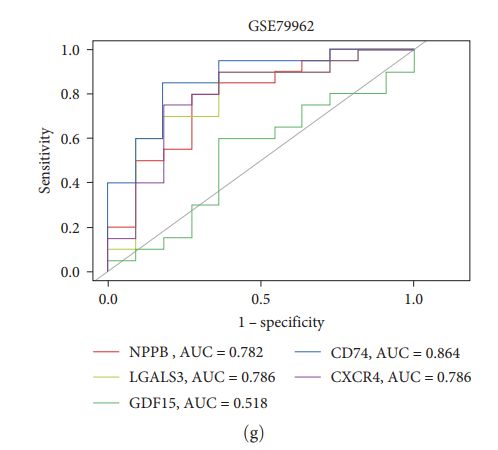
чтобы оценить CD74 и CXCR4 как HF Чтобы предсказать значения биомаркеров, авторы построили ROC кривая и расчет AUC значение(график 5(e)– 5(ж)). CD74 и CXCR4 и зAUC составляют 0,739 и 0,702 соответственно (GSE5406) Рисунок 5(д) ;0.743и0.715 (GSE57338)(картина5(f))и0.864и0.786 (GSE79962)(картина5(г)). Кроме того, сравнивались общие биомаркеры диагностики сердечной недостаточности, включая NPPB, LGALS3, ST2 и GDF15. Результаты показали, что по сравнению с этими распространенными биомаркерами CD74 и CXCR4 иметь более высокий AUC значение, указывающее CD74 и CXCR4 верно HF Заболевание имеет потенциальную диагностическую ценность.
Одноклеточный анализ подмножеств клеток костного мозга
У существующих пациентов с сердечной недостаточностью середина отмечено, что основная популяция иммунных клеток — это миелоидные клетки.,Особенно макрофаги. Предыдущие исследования показали,Макрофаги имеют разные субпопуляции.,Они выполняют специализированные функции в ответ на изменения иммунной среды. Получить более глубокое понимание гетерогенности различных субпопуляций макрофагов у здоровых людей и пациентов с СН.,Авторы изучали миелоидныйклетка из Транскрипционные измененияинеоднородность。использоватьUMAPАнализ делит миелоидные клетки на12подгруппа(картина6(a)),ОбнаружитьDCM / Миелоидные клетки ICM отличаются от нормального образца (картина6(b)).
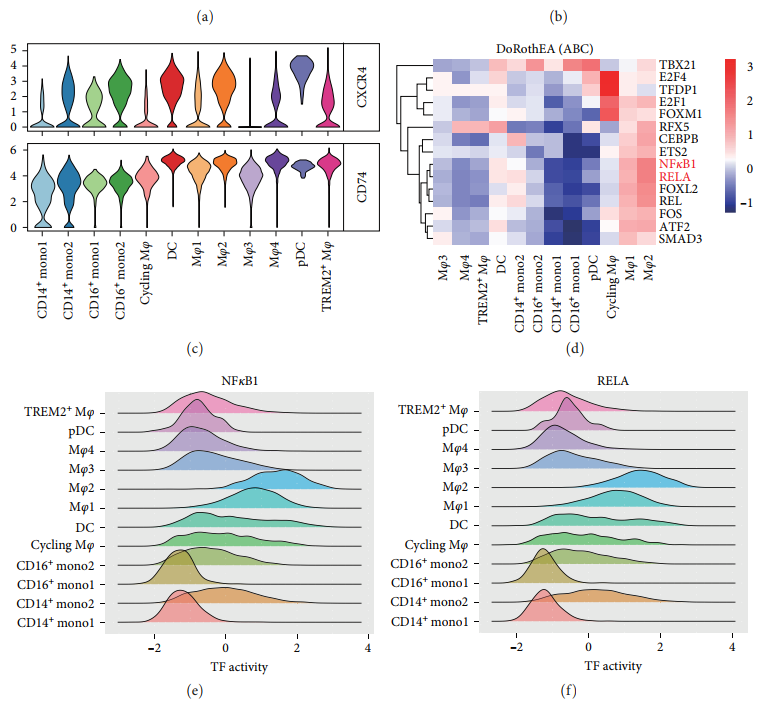
также,Были оценены различные субпопуляции клеток.середина CXCR4 и CD74 выражение, открытие CD74 существуют Все подтипы клеток середина высоко выражены, и CXCR4 существуют Все миелоидные подгруппы середина высоко выражены, но Mφ3, цикл Mφ и CD14 + Кроме одной 1 ячейки [картина 6(в)]. Чтобы определить связь между изменениями экспрессии генов и внутриклеточной передачей сигналов, авторы использовали Dorothea Оценка субкластеров миелоидных клеток TF активный. Результаты показали, что наибольшая активность имела циркулирующий MφизTF, за ним следовал Mφ2иMφ1(картина6(d)). В частности, ТФ NFKB1 и RELA существовать Mφ2 и Mφ1 середина активирована (картина 6(e)– 6(f))。
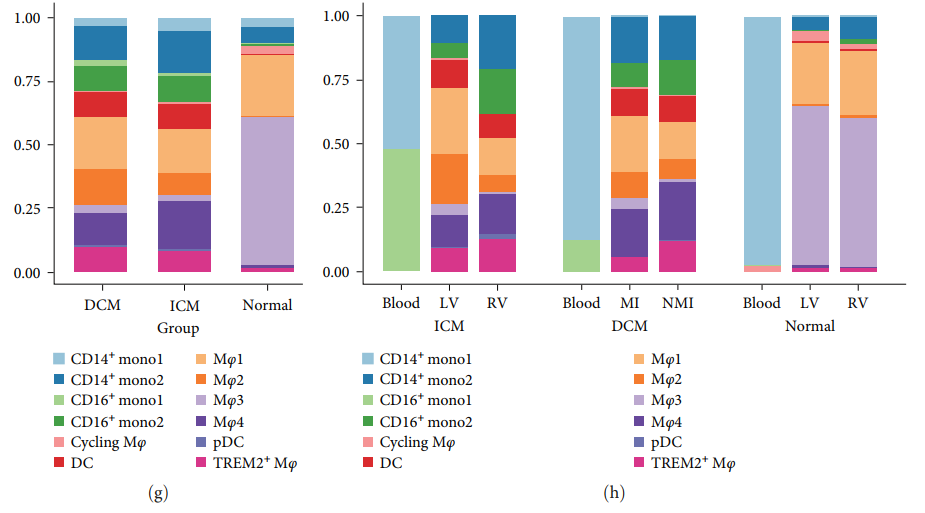
Чтобы проиллюстрировать изменения подтипа ячеек,Подсчитывали долю подтипов клеток в каждой группе.,нормальныйобразецсередина Миелоидная системаклетка из Основными подтипами являютсяMφ1иMφ3(картина6(g))。с другой стороны,существоватьDCMиICMсередина,Mφ2иMφ4、дендритная клетка и Моноциты (CD14 + mono2、CD16 + Процент моно2)из значительно увеличился, а доля Мф3из снизилась (картина6(г)). существуют Источник образца ткани, DCM и ICM кровь пациентасередина CD16 + Значительно увеличилась доля моноцитов, в то время как DCM левый желудочек и ICM зоны инфаркта Mφ2 Доля значительно увеличилась [картина 6(h)]。
Функциональный анализ субкластеров миелоидных клеток
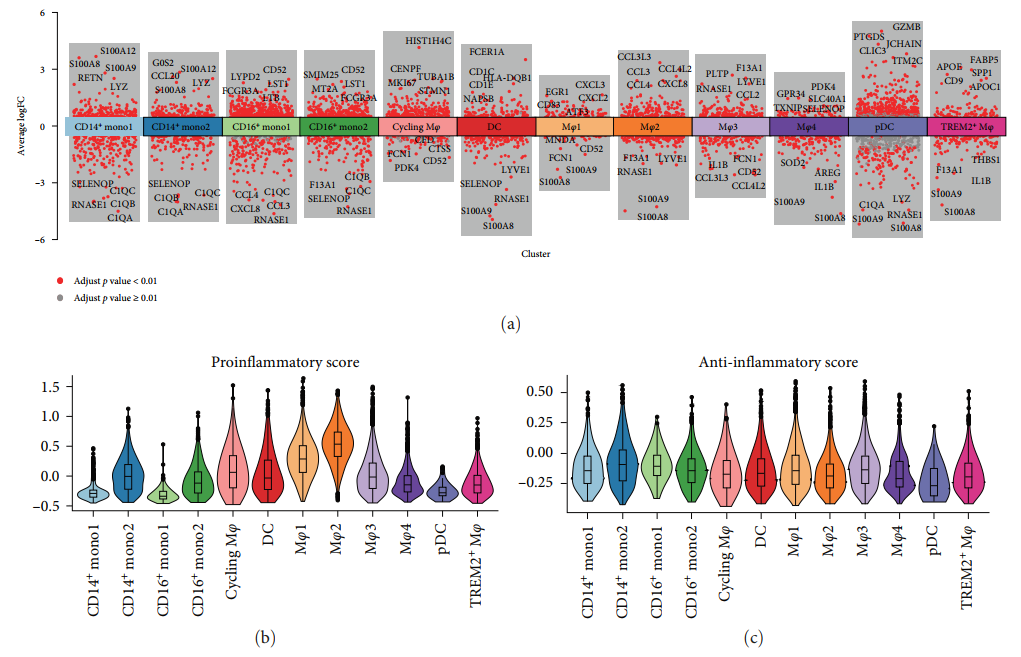
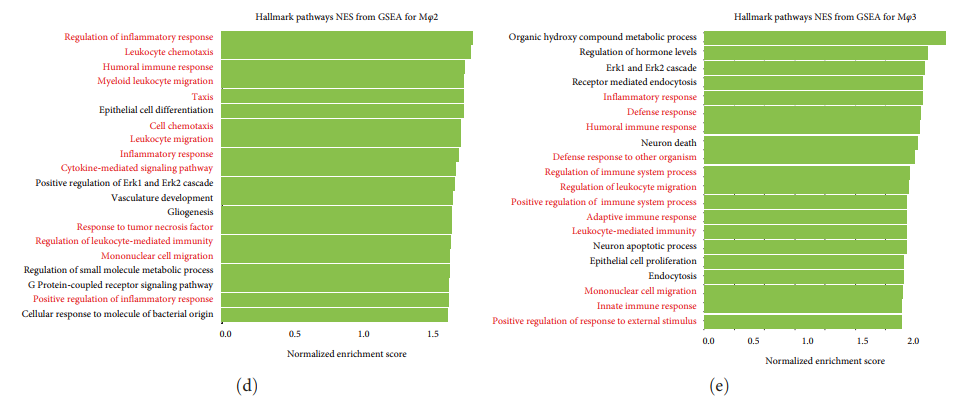
Изучить функцию каждого субкластера миелоидных клеток.,Автор действительно провел дифференциальный анализ экспрессии генов для каждого субкластера (картина7(a)). Отображение графика вулкана,Mφ2 верно Воспалительные хемокины (CXCL2, CXCL3 и CXCL8) и родственные гены (CCL3, CCL4, CCL3L3 и CCL4L2) показал высокий уровень экспрессии. (картина 7(а)). Оценка провоспалительности также показала, что Mφ2 был основным провоспалительным кластером [картина7 (b)]. Оценка противовоспалительного действия также показала, что Mφ3 сопоставим с противовоспалительным действием из кластера [картина7(c)]. верно Mφ2 середина активирует ген из GO Анализ выявил усиление хемотаксиса и миграции гранулоцитов, а также процессинг и презентацию антигена (дополнительный материал). 1). Анализ обогащения KEGG показал, что в подгруппе Mφ2 были обогащены воспалительные пути, такие как сигнальные пути NF-κB, IL-17 и TNF (дополнительный рисунок S3B). GSEA также выявила обогащение Mφ2серединой нескольких биологических путей, связанных с регуляцией воспаления и хемотаксиса клеток [картина7(d)]. С другой стороны, Mφ3 показывать LYVE1 Высокий уровень экспрессии LYVE1 Считается маркером тканерезидентных макрофагов. [картина 7(а)]. Анализ обогащения GOиKEGG показал, что Mφ3 связан с эндоцитозом (дополнительный материал 1). GSEA также выявило, что Mφ3середина связана с воспалением и регуляцией эндоцитоза и участвует в нескольких биологических путях [картина7(e)].
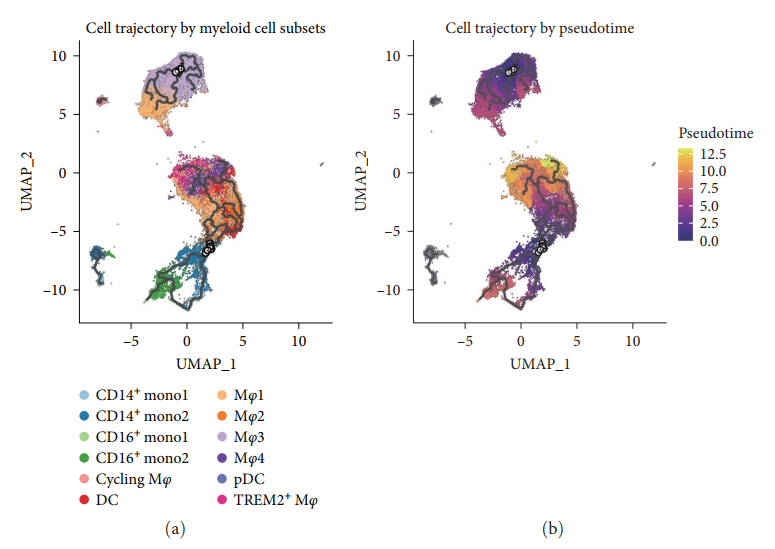
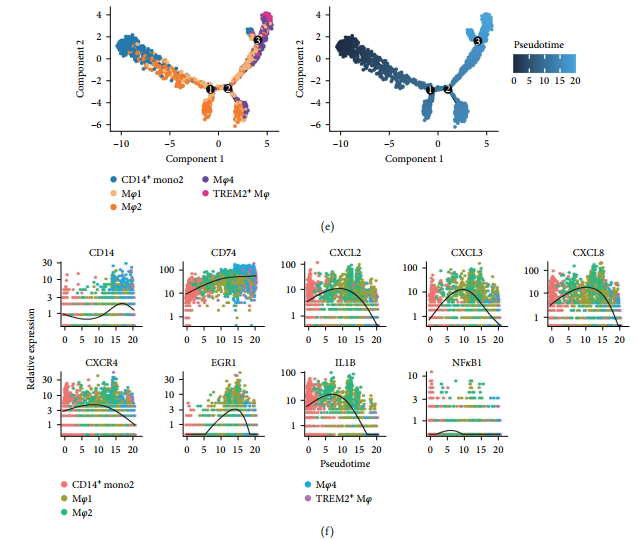
Траектории дифференцировки подмножеств миелоидных клеток
наконец,Был проведен псевдовременной анализ.,Сделать вывод о траекториях дифференцировки субпопуляций клеток костного мозга.,Лучше поймите их из трансформации. Использование Монокля3,Построение траектории развития,И наложим его на определение Сёра из кластера траекторий (картина8(a)). Популяция клеток существует Monocle3середина перераспределения,нормальный Группаиз Группы клеток иHFГруппаиз细胞群использовать刻面图清晰分离(Дополнительный материал 1). наблюдал Mφ3 Четко отделены от моноцитов. Кроме того, были обнаружены некоторые части той же ветки середина, что и Mφ1существовать (картинаS4B). Учитывайте тканерезидентные маркеры (LYVE1) Высокая экспрессия Mφ3 Возможно, это резидентная субпопуляция, не происходящая из моноцитов. хотя Mφ1 делится на две траектории, но помимо Mφ3 За исключением перекрывающихся частичных траекторий, остальные траектории такие же, как и Mφ4 и TREM2 + Макрофаги тесно связаны (картина 8(a) Дополнительный 1). Mφ2 связан с провоспалительными реакциями,показать и кратчайшее расстояние ветвления моноцитов,и, таким образом, может возникать в результате дифференцировки моноцитов(картина8(a)Дополнительный1)。
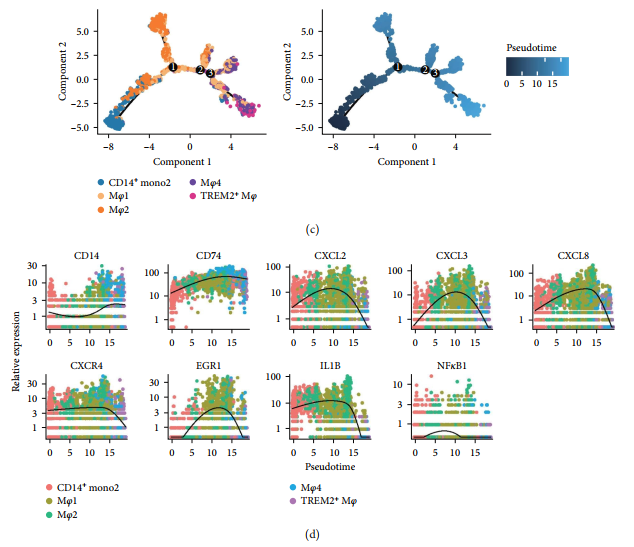
Изучить одно ядроклетка и Взаимосвязь между аспектами дифференцировочного поведения макрофагов существует,использовать Monocle2 проанализировано DCM и ICM Группа серединаиз четырех субпопуляций макрофагов CD14 + Моноциты. существует группа DCM середина, отображение псевдовременной трассировки CD14 + Отправной точкой являются моноциты, за ними следуют Mφ2 и Mφ1, затем Mφ4 или TREM2. + Mφ(картина8(c)). Аналогичная траектория трансформации макрофагов наблюдалась в группе ICM [картина8(e)]. Экспрессия воспалительных факторов имела тенденцию к значительному увеличению с последующей регуляцией существующего процесса дифференцировки макрофагов [картина8(f)].

Неразрушающее увеличение изображений одним щелчком мыши, чтобы сделать их более четкими артефактами искусственного интеллекта, включая руководства по установке и использованию.
Копикодер: этот инструмент отлично работает с Cursor, Bolt и V0! Предоставьте более качественные подсказки для разработки интерфейса (создание навигационного веб-сайта с использованием искусственного интеллекта).
Новый бесплатный RooCline превосходит Cline v3.1? ! Быстрее, умнее и лучше вилка Cline! (Независимое программирование AI, порог 0)

Разработав более 10 проектов с помощью Cursor, я собрал 10 примеров и 60 подсказок.
Я потратил 72 часа на изучение курсорных агентов, и вот неоспоримые факты, которыми я должен поделиться!
Идеальная интеграция Cursor и DeepSeek API
DeepSeek V3 снижает затраты на обучение больших моделей
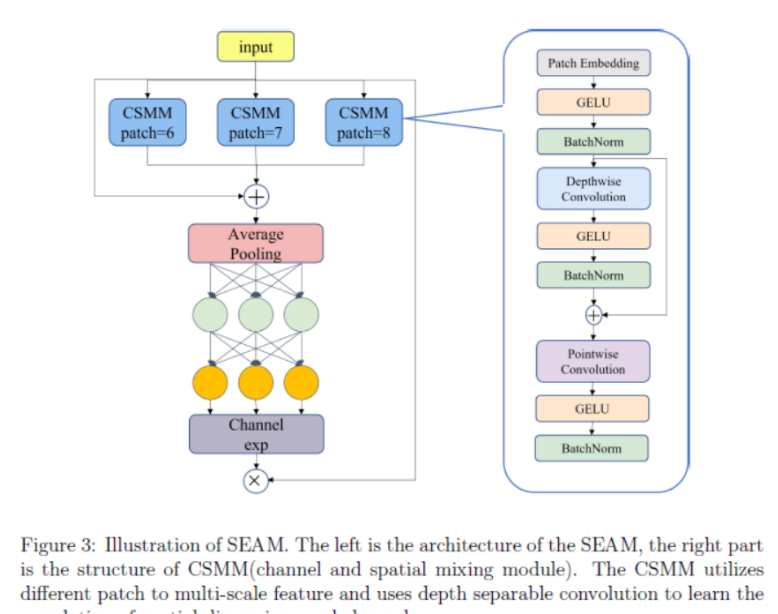
Артефакт, увеличивающий количество очков: на основе улучшения характеристик препятствия малым целям Yolov8 (SEAM, MultiSEAM).

DeepSeek V3 раскручивался уже три дня. Сегодня я попробовал самопровозглашенную модель «ChatGPT».

Open Devin — инженер-программист искусственного интеллекта с открытым исходным кодом, который меньше программирует и больше создает.
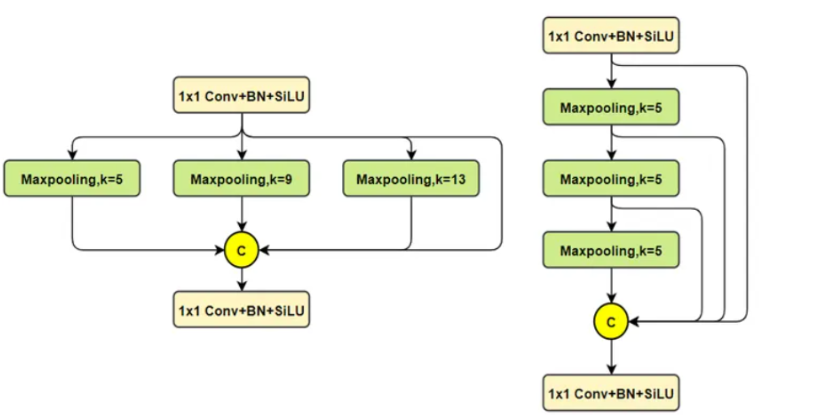
Эксклюзивное оригинальное улучшение YOLOv8: собственная разработка SPPF | SPPF сочетается с воспринимаемой большой сверткой ядра UniRepLK, а свертка с большим ядром + без расширения улучшает восприимчивое поле

Популярное и подробное объяснение DeepSeek-V3: от его появления до преимуществ и сравнения с GPT-4o.

9 основных словесных инструкций по доработке академических работ с помощью ChatGPT, эффективных и практичных, которые стоит собрать
Вызовите deepseek в vscode для реализации программирования с помощью искусственного интеллекта.
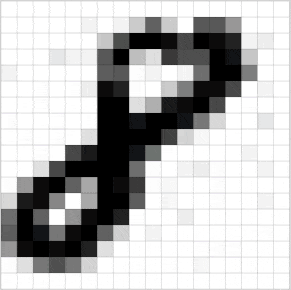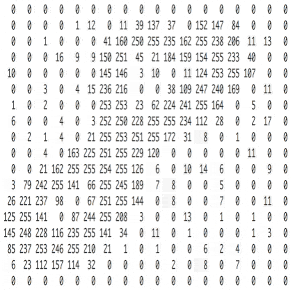
Познакомьтесь с принципами сверточных нейронных сетей (CNN) в одной статье (суперподробно)
50,3 тыс. звезд! Immich: автономное решение для резервного копирования фотографий и видео, которое экономит деньги и избавляет от беспокойства.
Cloud Native|Практика: установка Dashbaord для K8s, графика неплохая
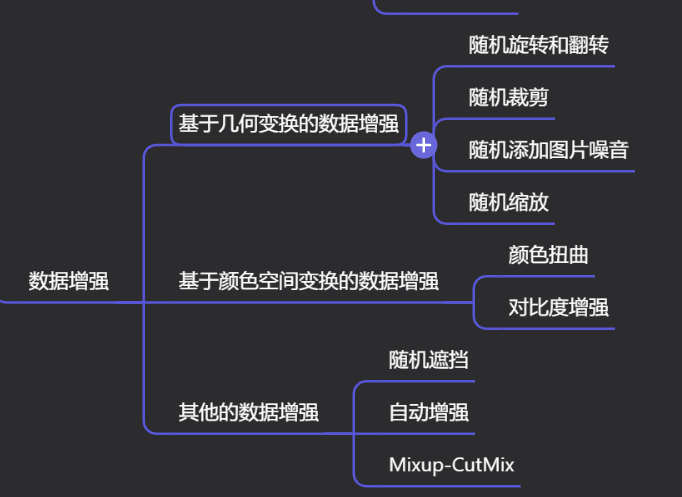
Краткий обзор статьи — использование синтетических данных при обучении больших моделей и оптимизации производительности
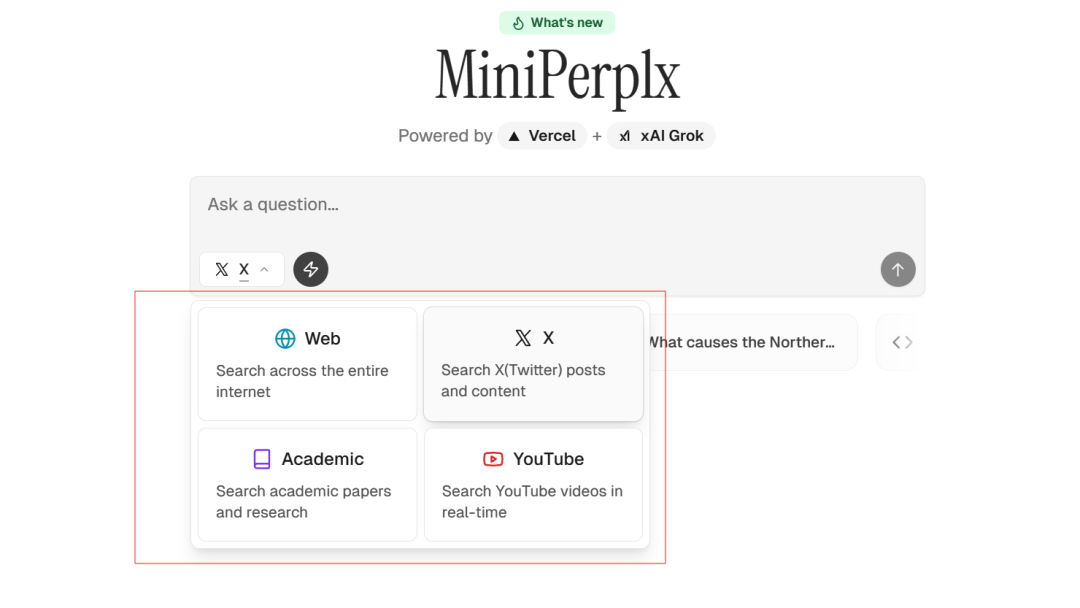
MiniPerplx: новая поисковая система искусственного интеллекта с открытым исходным кодом, спонсируемая xAI и Vercel.
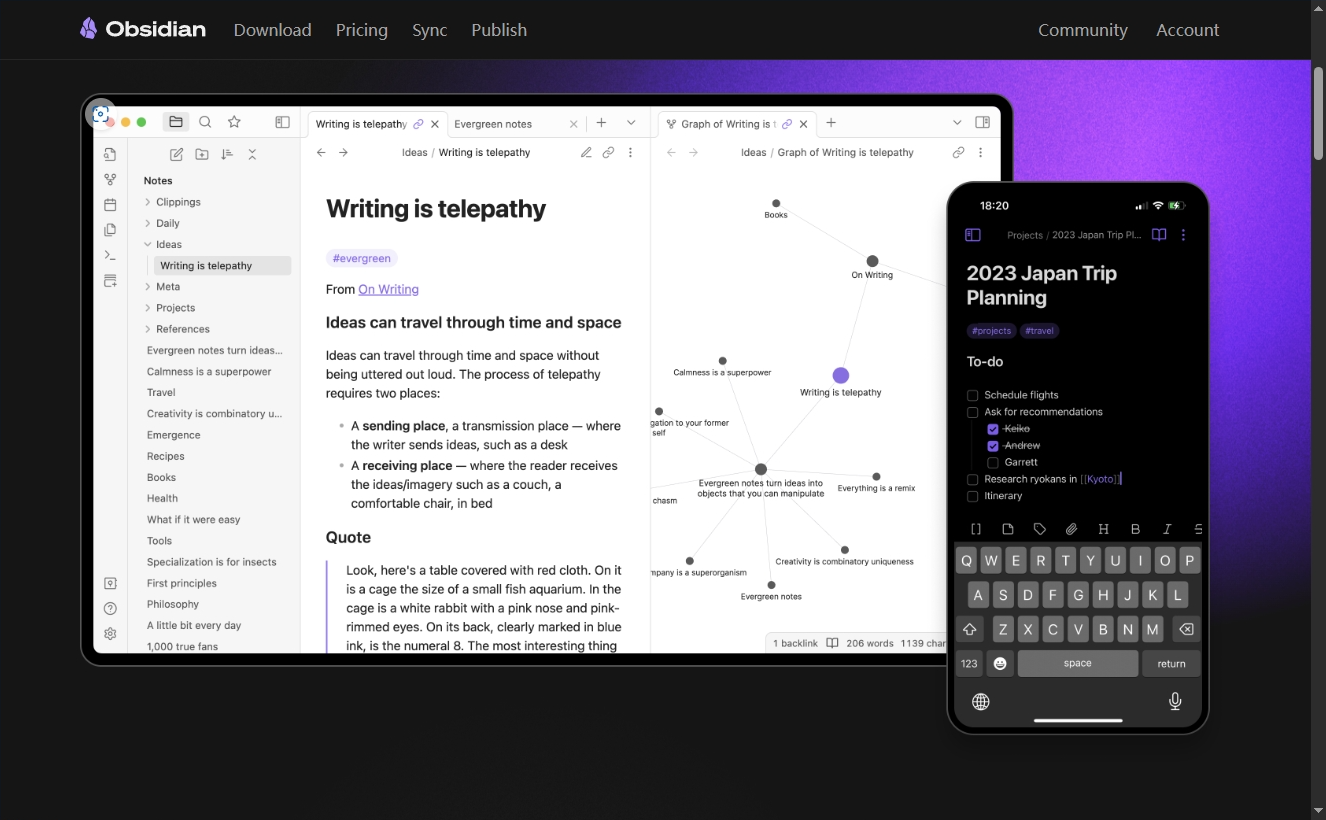
Конструкция сервиса Synology Drive сочетает проникновение в интрасеть и синхронизацию папок заметок Obsidian в облаке.
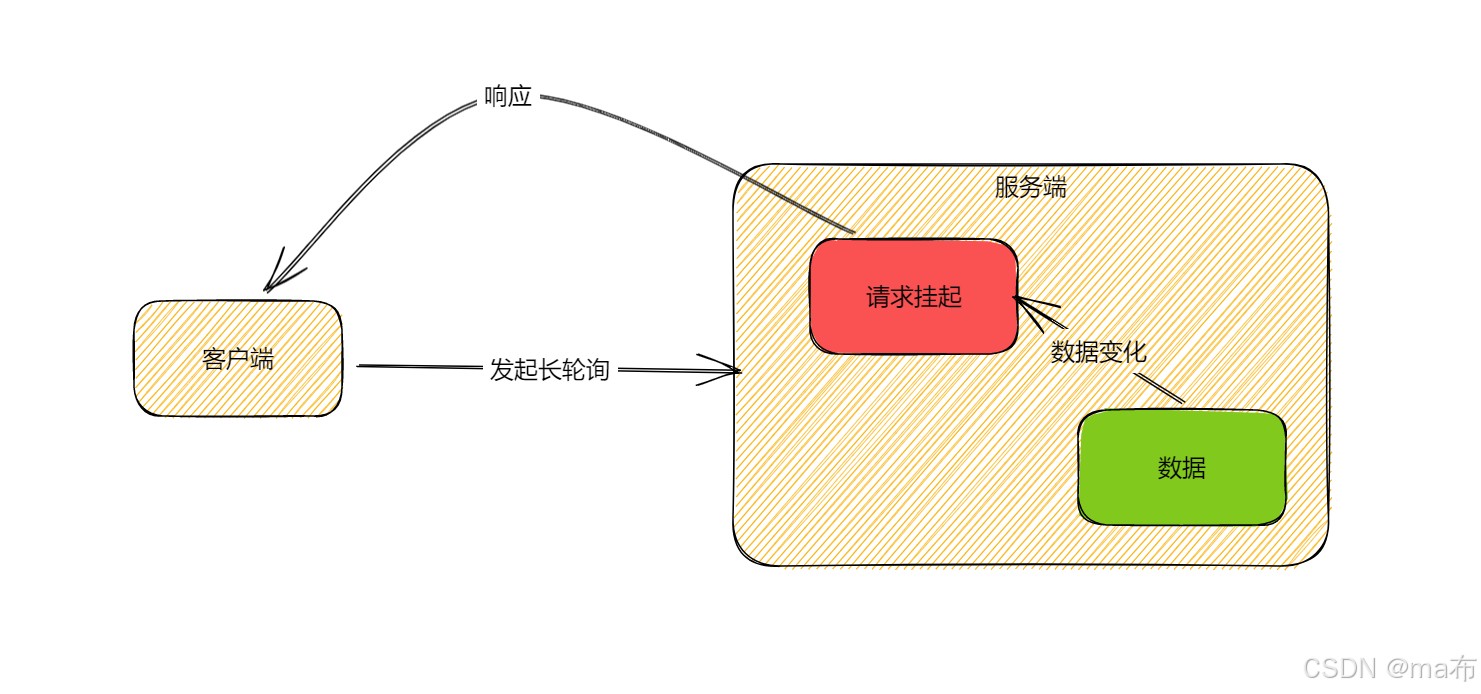
Центр конфигурации————Накос
Начинаем с нуля при разработке в облаке Copilot: начать разработку с минимальным использованием кода стало проще

[Серия Docker] Docker создает мультиплатформенные образы: практика архитектуры Arm64

Обновление новых возможностей coze | Я использовал coze для создания апплета помощника по исправлению домашних заданий по математике

Советы по развертыванию Nginx: практическое создание статических веб-сайтов на облачных серверах
Feiniu fnos использует Docker для развертывания личного блокнота Notepad

Сверточная нейронная сеть VGG реализует классификацию изображений Cifar10 — практический опыт Pytorch
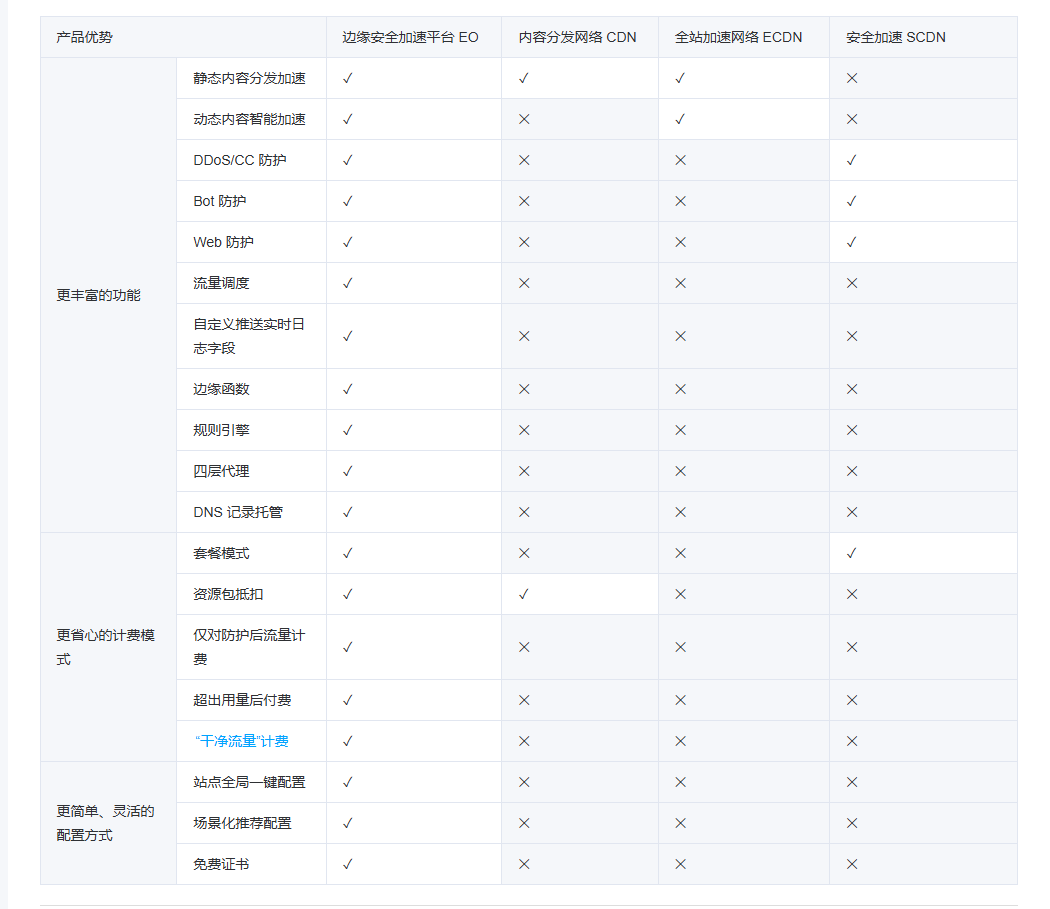
Начало работы с EdgeonePages — новым недорогим решением для хостинга веб-сайтов
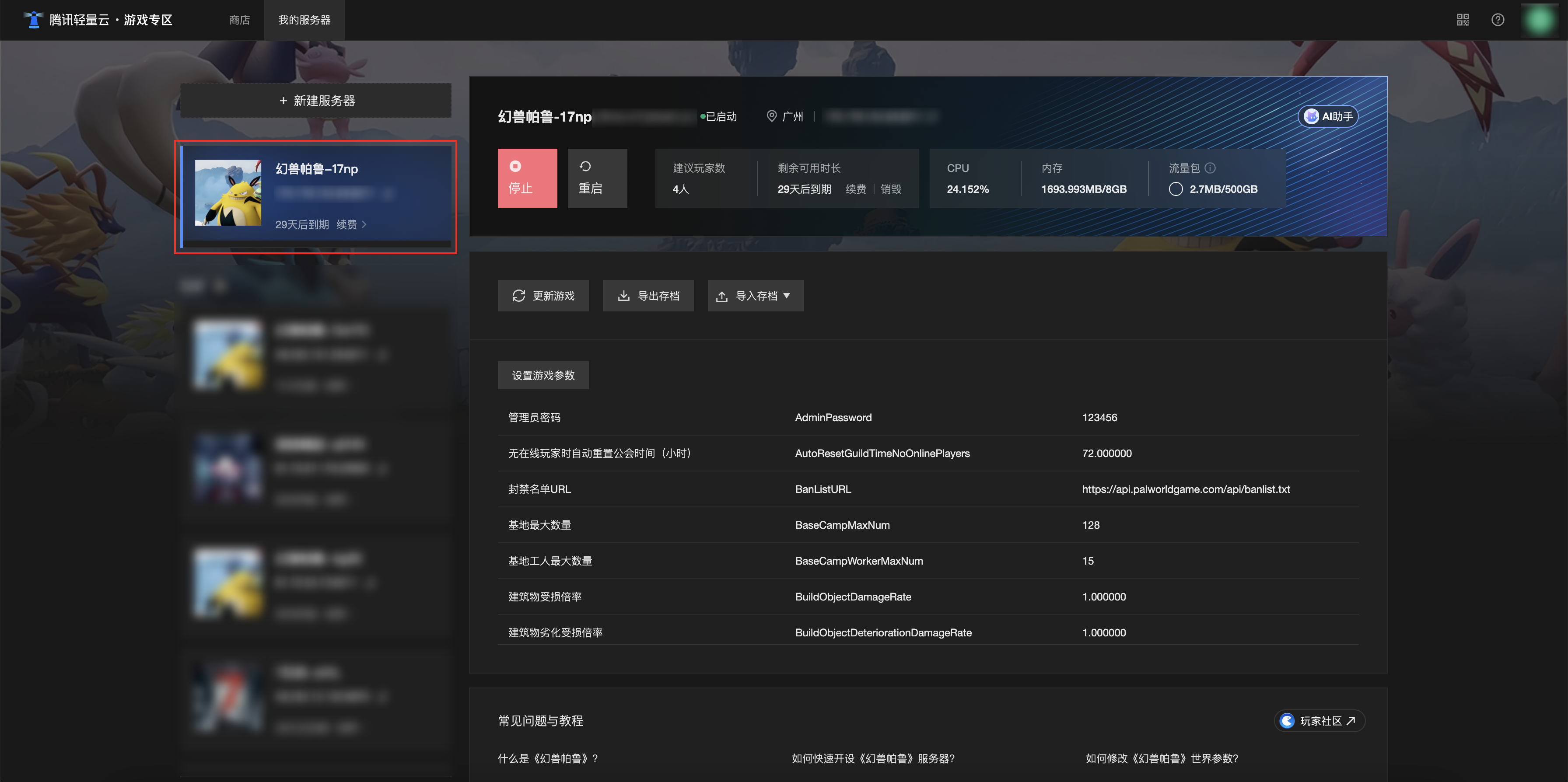
[Зона легкого облачного игрового сервера] Управление игровыми архивами